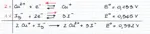valeg96
2018-08-09 14:15
Già nel 2010 l'utente **R@dIo@TtIvO** ha presentato una sintesi di questo composto in una discussione finita un pò infelicemente. Da allora, la sintesi non è stata più migliorata e/o elaborata con i suggerimenti proposti ancora 8 anni fa. In questo thread ci affidiamo ad una metodica ed a nozioni contenute in Inorganic Syntheses, Vol. 6. Per iniziare, una rapida introduzione teorica a ciò che stiamo per fare. Tecnicamente, l'aggiunta di ioduro a una soluzione di Cu(II) produce CuI2, che dismuta: 2 CuSO4 + 4 KI → 2 CuI2 + 2 K2SO4 2 CuI2 → 2 CuI + I2 In realtà, questa reazione è così rapida che ciò che osserviamo noi, complessivamente, è che lo ioduro di rame (I), estremamente insolubile (0.0042 mg /100 mL a 25°C) precipita rapidamente. Questo denso solido, che dovrebbe essere bianco, è in realtà rosa/bruno/viola a causa di tracce di iodio libero (prodotto dalla dismutazione) che si adsorbono ad esso. Lavare via lo iodio libero e sbiancare CuI dopo la precipitazione è molto difficile, e bisogna dunque lavorare in presenza di un agente riducente. Proprio come nella titolazione iodometrica del rame ci affidiamo al tiosolfato di sodio, che reagisce con lo iodio libero prodotto, ossidandosi a tetrationato, e riducendolo a ioduro: 2 Na2S2O3 + I2 → Na2S4O6 + 2 NaI A questo punto, la reazione complessiva è: 2 CuSO4 + 4 KI + 2 Na2S2O3 → 2 CuI + 2 K2SO4 + Na2S4O6 + 2 NaI L'impiego di entrambi i reagenti deve essere prudente: CuI è solubile sia in eccesso di tiosolfato, che di ioduro, in quanto forma ioduro-complessi e tiosolfato-complessi solubili, presumibilmente di formula [Cu(L)3]2-. Inoltre, è necessario lavorare con reagenti puliti, e senza contaminazioni acide, poiché il tiosolfato si decompone formando zolfo insolubile finissimo, che contaminerà irrimediabilmente il prodotto: S2O32- + 2 H+ → SO2 + S + H2O lo ioduro di rame così prodotto è un solido relativamente stabile, ma che se esposto all'aria e alla luce per anche un paio di ore, ingiallisce per liberazione di iodio. Altri metodi di sintesi di CuI (reazione fra Cu metallico ed I2 elementare, dissoluzione di Cu in HI bollente, gorgogliamenti di SO2 gassosa e quant'altro) sono di insignificante rilevanza sintetica. Se si è ben forniti, si possono ottenere buoni risultati anche con acido solforoso, solfiti e bisolfiti.
La sintesi vera e propria si svolge imitando una titolazione, per poter unire i reagenti senza lavorare in eccesso, garantendo così un'alta resa (a meno delle perdite meccaniche, beninteso). E' quindi necessaria una buretta (o almeno una pipetta graduata, o in mancanza di esse, tanta pazienza) e un agitatore magnetico. E' inoltre molto comodo un büchner, per filtrare rapidamente il denso prodotto. I reagenti impiegati sono: Solfato di rame pentaidrato, 12.5 g
![[Irritante]](images/irritante.png.pagespeed.ce.KZwWJmvAGL.png) Ioduro di potassio, 18.25 g
Tiosolfato di sodio, 14 g
Acqua distillata, circa 250 mL
Etanolo al 96%, circa 60 mL
Ioduro di potassio, 18.25 g
Tiosolfato di sodio, 14 g
Acqua distillata, circa 250 mL
Etanolo al 96%, circa 60 mL ![[Infiammabile]](images/infiammabile.png.pagespeed.ce.Yw0knUm38k.png) Si prepara una soluzione con 12.5 g di solfato di rame pentaidrato in 50 mL di acqua. Se il prodotto è di grado industriale/agricolo può essere necessario filtrare la soluzione per gravità, su un filtro il più piccolo possibile, o su cotone. Io ho filtrato con imbuto da 6 cm, su carta, e lavando il filtro con 2 x 10 mL di acqua.
Si prepara una seconda soluzione di 18.25 g di KI e 14 g di tiosolfato sodico pentaidrato in un matraccio da 50 mL. In alternativa, se non si desidera essere quantitativi più avanti con la buretta, si può usare qualsiasi altro contenitore.
Si prepara una soluzione con 12.5 g di solfato di rame pentaidrato in 50 mL di acqua. Se il prodotto è di grado industriale/agricolo può essere necessario filtrare la soluzione per gravità, su un filtro il più piccolo possibile, o su cotone. Io ho filtrato con imbuto da 6 cm, su carta, e lavando il filtro con 2 x 10 mL di acqua.
Si prepara una seconda soluzione di 18.25 g di KI e 14 g di tiosolfato sodico pentaidrato in un matraccio da 50 mL. In alternativa, se non si desidera essere quantitativi più avanti con la buretta, si può usare qualsiasi altro contenitore.





I seguenti utenti ringraziano valeg96 per questo messaggio: ohilà, NaClO, EdoB, Copper-65, AminewWar, Roberto, ClaudioG., Scienza pazza