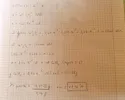Mariarosaria91
2016-09-11 10:04
Buon giorno a tutti ho risolto questo esercizio ma ho qualche dubbio mi sapreste gentilmente dire se ho commesso qualche errore grazie!
Un campione contenente CaCl2 è stato saggiato nel modo seguente:
60milligrammi del campione sono stati solubilizzati in 100 mL di acqua deionizzata; 15mL di detta soluzione sono stati prelevati, diluiti a 25mL, ed addizionati di C2O42- in eccesso; il precipitato è stato raccolto, ridisciolto in ambiente acido, e titolato con 6mL di una soluzione di KMnO4. Il titolo della soluzione di permanganato è stato ricavato sapendo che 9mL di detta soluzione titolano 3.5mL di una soluzione di acqua ossigenata all’0.05% (p/v).
a) Scrivere tutte le reazioni coinvolte;
b) Calcolare la percentuale di purezza del campione di partenza.
(PM CaCl2 = 111.0; PM H2O2 = 34.0)