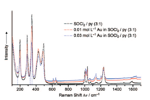
L'SOCl2 è consumata non stechiometricamente dalla dissoluzione dell'Au nella miscela SOCl2/py. Questo è evidente dalle intensità Raman delle bande vibrazionali ridotte a Δν = 200.0, 288.5, 348.2, 427.5, e 493.0 cm�-1 in Figura 2. Le bande relative alla py a Δν = 657.3, 1000.9, 1035.4, e 3064.6 cm�-1 si spostano a 643.5, 1013.5, 1027.3, e 3101.4 cm�-1, rispettivamente. Lo spostamento della bande è completo ad una concentrazione di AuIII tanto bassa quanto 0.03 molL-�1. Proporzionalmente, gli spettri NMR della soluzione 0.03M di Au/SOCl2/py mostra segnali totalmente spostati di 14N (ca. δ=-�10.4 ppm), 13C (ca. δ=�-0.46, -0.14, e -0.50 ppm per C2, C3, and C4, rispettivamente), ed 1H (ca. δ=�-0.06, �-0.04, e �-0.04 ppm per H2, H3, and H4, rispettivamente) relativi alla miscela 3:1 SOCl2/py prima della dissoluzione di Au.
Questi risultati suggeriscono una reazione chimica non stechiometrica nella soluzione. Lo spettro 13C-NMR a stato solido di GTP-RT mostra segnali per C4, C2, e C3 a δ=147.7, 142.2, e 129.2 ppm, rispettivamente. Questo è davvero in grande accordo con gli spettri 13C-NMR calcolati di oligomeri della 4-cloropiridina. La protonazione dell'atomo di azoto può essere confermata dall'apparizione della banda vibrazionale di NH+ ad approssimativamente 3222 cm�-1 negli spettri FT-IR di GTP-RT e della soluzione Au/SOCl2/py. La struttura dello ione piridinio è anche riflessa nel voltammogramma della soluzione di oro/organicus liquor regius in acetonitrile, dove il picco del potenziale di riduzione a -�1.28 V nella scansione catodica cande nel range dei potenziali di riduzione dei composti piridinio.[28] I dimeri ed i trimeri della 4-cloropiridina e dei loro derivati sono presenti negli spettri di massa di GTP-RT e nel precipitato della soluzione Au/SOCl2/py lasciata stare per lungo tempo. Postuliamo che la 4-cloropiridina potrebbe formare un intermedio e che l'AuIII catalizzi l'oligomerizzazione della 4-cloropiridina.[29, 30] La natura oligomerica è evidente dal fatto che GTP-L è molto viscoso. L'aumentata viscosità causa un bassa mobilità delle molecole, e questa bassa mobilità potrebbe essere la ragione dell'ampliamento del segnale osservato nello spettro 13C-NMR della soluzione Au/SOCl2/py. In accordo con quanto postulato, diversi metalli come Au, Ag, e Cu esibiscono diversi effetti catalitici.[30] La reazione di oligomerizzazione spiega l'aspetto non stechiometrico.
L'Au dissolto può essere ricoverato tramite calcinazione. In GTP-160, l'Au recuperato ed i residui esagonali simili a bastoncino possono essere osservati tramite SEM (Figura 3d e f). A confronto con GTP-RT, le intensità Raman delle bande basate sulla py sono ridotte per i bastoncini (Figura 3 e); nel frattempo, le bande di AuIII‒�Cl sono evidenti. In GTP-230, viene osservata una completa decomposizione di GTP-RT in dischi di Au esagonali tramite SEM (ca. 10 mm in dimensione, Figura 3g e i). Questi dischi di Au ben formatisi hanno una orientazione {111}.
L'organicus liquor regius può essere formulato usando non solo la py ma anche altri solventi organici/reagenti, quali N,N-dimetilformammide (DMF), imidazolo, pirimidina, e pirazina.
Per esempio, una miscela SOCl2/DMF discioglie Au ad una velocità di 0.3 molm�-2h-�1; invece, né Pd né Pt sono apparentemente dissolti. Una caratteristica chiave che tutte queste specie organiche hanno in comune è che esse possono subire interazioni a trasferimento di carica con SOCl2.[20, 26, 31] Sebbene nessuna analisi quantitativa abbia finora fornito una risposta alla questione per la quale l'organicus liquor regius mostri una reattività differente con differenti composizioni nei confronti di differenti metalli nobili, si può assumere ragionevolmente che la selettività nella dissoluzione derivi dall'interazione regolabile tra SOCl2 ed il solvente organico/reagenti. Ulteriori studi fondamentali sistematici sull'organicus liquor regius sono direzioni promettenti per la ricerca futura.
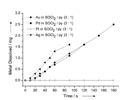
I nostri studi cinetici dimostrano che la dissoluzione selettiva dei metalli nobili è un processo efficiente (Figura 4). La selettività nella dissoluzione aprirebbe una nuova strada verso il riciclo dei metalli nobili, in particolare del Pt. Accanto all'applicazione nel recupero di metalli nobili, l'organicus liquor regius troverà vaste applicazioni nell'industria microelettronica.
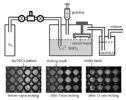
La Figura 5 mostra la fattibilità della lisciviazione tramite “vapore” della metallazione dell'Au su una scheda circuito tramite organicus liquor regius vaporizzato. Riteniamo che l'organicus liquor regius aprià un nuovo campo di vasto interesse.
Parte Sperimentale
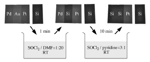
I composti chimici nella presente ricerca sono stati tutti acquistati dalla Sigma–Aldrich ed usati senza alcuna purificazione. L'organicus liquor regius è stato preparato aggiunge i composti organici a SOCl2 in un bagno di ghiaccio. Il processo di dissoluzione è riproducibile indipendentemente dal fatto che venga condotto all'aria o sotto azoto. Per la dissoluzione dell'Au, una certa quantità di filo di Au (50 mm in diametro), di film (250 nm di spessore, depositato su substrati di silicio tramite electron-beam evaporation), o di foglie (50 mm di spessore) di massa nota sono stati testati a temperatura ambiente. La velocità di dissoluzione dell'Au dipende dalla temperatura, dalla composizione dell'organicus liquor regius, e, in misura minore, dalla forma dell'Au utilizzata. Per paragone e consistenza. abbiamo usato l'unità molm�-2h-�1 negli studi cinetici, in accordo col Rif. [13]. Dopo dissoluzione dell'Au, l'eccesso di SOCl2 nella soluzione Au/SOCl2/py è stato rimosso completamente gorgogliando la soluzione con N2. Il prodotto liquido così ottenuto è stato nominato GTP-L. Il suo prodotto solido (GTP-RT) è stato ottenuto tramite essiccazione a temperatura ambiente in vuoto (15 KPa) per 48 h. Il GTP-160
ed il GTP-230 designano i prodotti del GTP-RT purificato dopo trattamenti termici a 160°C per 10 min e a 230°C per 10 min, rispettivamente.
Riferimenti
[1] Designiamo col nome name “organicus liquor regius” le miscele di SOCl2 e solventi organici/reagenti per le seguenti ragioni: 1) la capacità ossidante dell'organicus liquor regius, come è discussa nell'articolo, è a causa dell'effetto di catalisi del solvente organico/reagente piuttosto che dell'SOCl2 medesimo; 2) le miscele SOCl2/py con rapporti volumetrici a parte 3:1 sono in grado di dissolvere i metalli nobili, così come gli altri sistemi; 3) SOCl2 è per natura un composto inorganico ma è diffusamente usato in sintesi organica e gioca un ruolo più importante in chimica organica piuttosto che in chimica inorganica. Noi presentiamo solo degli studi sistematici sulle miscele Au/SOCl2/py perché alcune importanti proprietà della py e di SOCl2 sono state ben documentate. Ci focalizziamo sulle miscele SOCl2/py con un eccesso di SOCl2 (ossia, 3:1) per la facilità di purificazione. Inoltre, variando il rapporto molare delle miscele SOCl2/py non cambiamo il carattere non stechiometrico delle reazioni.
[2] B. C. H. Steele, A. Heinzel, Nature 2001, 414, 345.
[3] J. Zhang, K. Sasaki, E. Sutter, R. R. Adzic, Science 2007, 315, 220.
[4] B. Lim et al., Science 2009, 324, 1302.
[5] F. T. Awadalla, R. E. Molnar, G. M. Riteey, US Patent, 5,304,233, 1992.
[6] R. I. Edwards, M. J. Nattrass, US Patent 4,105,742, 1978.
[7] J. B. Lakewood, C. Arvada, US Patent 4,041,126, 1977.
[8] M. T. R�is�nen, M. Kemell, M. Leskela, T. Repo, Inorg. Chem. 2007, 46, 3251.
[9] T. Mortier, A. Persoons, T. Verbiest, Inorg. Chem. Commun. 2005, 8, 1075.
[10] L. Cau et al., Dalton Trans. 2003, 1969.
[11] Y. Nakao, J. Chem. Soc. Chem. Commun. 1992, 426.
[12] G. Senanayake, Hydrometallurgy 2008, 90, 46.
[13] P. H. Qi, J. B. Hiskey, Hydrometallurgy 1991, 27, 47.
[14] C. Bou, M. Cruells, M. T. Romero, J. Vinals, Hydrometallurgy 1998, 48, 343.
[15] L. Pazderski, Magn. Reson. Chem. 2007, 45, 24.
[16] H. Schmidbaur, P. Jandik, Inorg. Chim. Acta 1983, 74, 97.
[17] B. Bovio, A. Burini, B. R. Pietroni, J. Organomet. Chem. 1993, 452, 287.
[18] Nessuna perdita di peso dal film di Au è stata rilevata dopo che è stata immersa in SOCl2 a temperatura ambiente o in formo a 70 °C (riflusso) per una settimana.
[19] G. Ricca, F. Severini, Polymer 1988, 29, 880.
[20] P.W. Schenk, R. Steudel, Angew. Chem. 1963, 75, 792; Angew. Chem. Int. Ed. Engl. 1963, 2, 685.
[21] R. Steudel, Y. Steudel, Eur. J. Inorg. Chem. 2007, 4385.
[22] J. A. Cade, W. Gerrard, Nature 1953, 172, 29.
[23] J. P. E. Human, J. A. Mills, Nature 1946, 158, 877.
[24] F. Higashi, T. Mashimo, I. Takahashi, J. Polym. Sci. Polym. Chem. 1986, 24, 97.
[25] E. E. Garcia, C. V. Greco, I. M. Hunsberger, J. Am. Chem. Soc. 1960, 82, 4430.
[26] S. V. Vinogradova, V. A. Pankratov, V. V. Korshak, L. I. Komarova, Russ. Chem. Bull. 1971, 20, 450.
[27] W. K. Istone, R. J. Brodd, J. Electrochem. Soc. 1982, 129, 1853.
[28] J. Volke, J. Urban,V. Volkeova, Electrochim. Acta 1994, 39, 2049.
[29] K. Kosuge, K. Nose, Y. Suzuki, K. Kamata, T. Iyoda, 214th ECS meeting, 2008, Abstract no. 1530.
[30] A. A. Berlin, E. F. Razvodovskii, J. Polym. Sci. Part C 1967, 16, 369.
[31] I. A. El-Sakka, N. A. Hassan, J. Sulfur Chem. 2005, 26, 33.
 dovremmo indagare.
dovremmo indagare.