Ciao a tutti!
Ho un dubbio semplice su un valore di pka.
Considerando il Mefobarbital:
[img=240x155]http://en.chembase.cn/Server/MolImages/CD/DE/CDDE63C9-A182-4192-A88F-FE74E9419FFF.png[/img]
Il suo valore di pka è di 7,8.
Tale valore a cosa si riferisce?
Io direi che il valore è riferito all'NH non sostituito in quanto presente un H che è acido, mentre l'altro azoto è sostituito e pertanto non ha più l'idrogeno disponibile.
Considerando, invece, la Fenitoina:
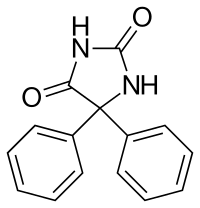 il valore di pka= 8,3 a cosa si riferisce?
Io direi che è riferito all'NH compreso tra i due carbonili (ovvero quello più lontano dagli anelli benzenici, cioè in posizione 3).
è corretto?
Grazie
il valore di pka= 8,3 a cosa si riferisce?
Io direi che è riferito all'NH compreso tra i due carbonili (ovvero quello più lontano dagli anelli benzenici, cioè in posizione 3).
è corretto?
Grazie
Il dubbio che hai è semplice, ma i tuoi tentativi di risposta mi fanno capire che ti mancano i concetti base di cos'è una coppia coniugata acido-base 
Se io ti dico che l'NH3 ha una pKa di 9,3, tu mi rispondi che tale valore è riferito ad uno dei tre idrogeni acidi???
Prova un attimo a meditare!!!
L'NH3 dà origine alla seguente dissociazione:
NH3 + H2O --> NH4+ + OH-
NH3 si comporta come base mentre NH4+ è il suo acido coniugato.
NH4+ + H2O --> NH3 + H3O+
La mia domanda era questa: "individuare nella struttura il centro a cui va attribuito il pka riportato".
In base a ciò ora direi che il centro nel Mefobarbital che dà pka=7,8 è dato dall'azoto sostituito, mentre nella Fenitoina il centro che dà pka= 8,3 è dato dall'azoto più vicino ai due anelli aromatici.
Io risponderei così:
Nel Mefobarbital l'azoto >N-CH3 è più basico dell'azoto >N-H, quindi quest'ultimo è più acido del primo.
Di conseguenza il centro >N+H2 cederà più facilmente un protone rispetto al centro >N+H-CH3.
I seguenti utenti ringraziano LuiCap per questo messaggio: Alaska
 il valore di pka= 8,3 a cosa si riferisce?
Io direi che è riferito all'NH compreso tra i due carbonili (ovvero quello più lontano dagli anelli benzenici, cioè in posizione 3).
è corretto?
Grazie
il valore di pka= 8,3 a cosa si riferisce?
Io direi che è riferito all'NH compreso tra i due carbonili (ovvero quello più lontano dagli anelli benzenici, cioè in posizione 3).
è corretto?
Grazie
