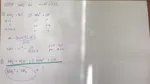giorgiari_99
2019-04-13 09:44
Buongiorno a tutti! Ho questo problema da risolvere:
Calcolare il pH di 1L di una soluzione 0.55 M di ammoniaca, il pH dopo l’aggiunta di 0.9 moli di cloruro ammonico e la variazione di pH dopo l’aggiunta di 0.025 moli di acido cloridrico, assumendo che il volume resti invariato. (ammoniaca pKb=4.74).
Su internet ho visto già allegato un procedimento del secondo punto..ho un dubbio
Prima dissocio il cloruro ammonico in NH4+ + Cl-
Poi, perchè visto che sto aggiungendo il cloruro ammonico all'ammoniaca la reazione è quella che ho evidenziato in verde?
So che non ha senso ma io avrei aggiunto NH4+ a NH3 visto che dice che il cloruro ammonico viene aggiunto alla soluzione di prima (ammoniaca)
Scusate se mi sono espressa poco bene, ditemi se vi è chiaro il mio dubbio