A prima vista, l'articolo intitolato "Epibatidina: un nuovo (cloropiridil)-azabicicloeptano con una potente attività analgesica ricavato da una rana velenosa ecuadoriana" non sembra granché interessante. I suoi autori sono Thomas F. Spande, Hugo Martin Garraffo, Michael W. Edwards, Herman J. C. Yeh, Lewis Pannell, John W. Daly, dell'Istituto Nazionale per il Diabete e le Malattie Digestive e Renali dei National Institutes of Health degli Stati Uniti, a Bethesda, nel Maryland. Gli studiosi avevano estratto e identificato la sostanza tossica con cui una rana tropicale si difende dai pretadori. Ma hanno pubblicato i loro risultati sulla più importante rivista di chimica del mondo (forse nel 1992, N.d.R.), il Journal of the American Chemical Society (Epibatidine: a novel (chloropyridyl)azabicycloheptane with potent analgesic activity from an Ecuadoran poison frog JACS (1992), 114, 3475), il che suggerisce che nell'articolo debba esserci qualcosa che interessava particolarmente i chimici. Qualcosa infatti c'è.
-Epibatidine_Structural_Formulae_V.1.svg/220px-(%2B)-Epibatidine_Structural_Formulae_V.1.svg.png)
Non solo l'epibatidina è molto tossica, e questo spiega perché gli indigeni utilizzino la pelle delle rane per costruire frecce avvelenate, ma si è rivelata anche un eccellente antidolorifico. La sua capacità analgesica sembrerebbe confermare la credenza popolare che la natura, da qualche parte, ha in serbo una cura per ogni malattia umana. L'epibatidina è anche un composto organoclorurato, il che sconvolge in qualche misura la convinzione degli ambientalisti che queste sostanze siano esclusivamente prodotti di sintesi dannosi per la salute e per l'ambiente. Questa idea viene da anni di campagne contro organoclorurati dannosi come il DDT, le diossine e i CFC. Anche l'epibatidina è molto pericolosa, ma è perfettamente naturale. Non sarebbe molto giusti, nei confronti delle rane, sterminarle tutte perché producono una pericolosa molecola organoclorurata.
Purtroppo i ricercatori hanno dovuto uccidere 750 di queste belle creature a strisce bianche e rosse per ricavare meno di un decimo di milligrammo del composto in esame. È stato però un sacrificio che ha dato dei risultati, perché si è scoperto che la tossina è una semplice molecola, facile da produrre in laboratorio. I ricercatori hanno anche mostrato che è 200 volte più potente della morfina, e per farlo si sono serviti del test della piastra rovente. In questo esperimento, alquanto rude, un ratto riceve l'antidolorifico e viene gettato su una piastra resa rovente dall'elettricità. Di norma l'animale balzerebbe immediatamente in aria, ma quelli che hanno ricevuto una dose di soli 5 μg di epibatidina restavano tranquilli ad aspettare, senza rendersi conto dei danni che il calore causava al loro corpo.
Ancor più sconcertante è stato osservare che quando a un ratto che aveva ricevuto epibatidina veniva iniettato naloxone, un composto che di norma neutralizza gli antidolorifici come la morfina, continuava a non reagire al calore bruciante. Evidentemente questo nuovo analgesico non agiva bloccando i consueti recettori dolorifici. O forse il cervelletto dell'animale possedeva qualche altro meccanismo per controllare il dolore? Si scoprì che in realtà l'epibatidina si lega al recettore della nicotina. Le molecole della nicotina e di epibatidina hanno una forma molto simile, con la differenza che l'epibatidina si lega con più forza. La ovvia deduzione è che questa molecola può avere effetti simili alla nicotina, ma con potenza notevolmente maggiore.
Nicotina ===> 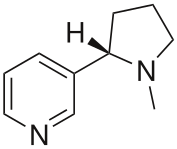
L'aumento dei livelli di dopamina indotto al cervelletto da parte della nicotina ha i suoi lati piacevoli, ma li si paga a caro prezzo. L'epibatidina può offrire un'alternativa più sicura alla nicotina? O è davvero troppo pericolosa?
Questa molecola affascina i chimici anche per altre ragioni. Per le rane arboree dai colori vivaci costituisce un efficace deterrente contro i predatori ed è altamente tossica, e questo è senza dubbio il motivo per cui gli animali la tengono confinata nella pelle. Ma come fanno a sintetizzarle? Quando sono allevate nell'ambiente tranquillo e sicuro del laboratorio, le rane non ne producono affatto, il che suggerisce che la loro dieta in natura debba contenere qualcosa indispensabile per crearla, o forse che la producono solo nell'ambiente selvatico, quando sono esposte alla continua minaccia dei predatori.
La storia dell'epibatidina è appena agli inizi. Può darsi benissimo che dai suoi sviluppi nasca un antidolorifico più efficace o una pillola che aiuti i fumatori a smettere. O anche che costituisca il punto di partenza per una pillola che agevoli l'apprendimento, o che migliori i risultati di altre attività intellettuali.
I seguenti utenti ringraziano quimico per questo messaggio: Rusty, Dott.MorenoZolghetti, jobba, Mario, Max Fritz, Beefcotto87, ENNIO VOCIRZIO, Sigmatropic, RhOBErThO
L'analisi retrosintetica della epibatidina suggeriva che un derivato 7-azabiciclo[2.2.l]ept-2-ene protetto ad hoc doveva essere un precursore valido. L'idrogenazione è stata progettata per dare una miscela di derivati eso ed endo che, è stato proposto, potevano esser convertiti nell'isomero desiderato, più stabile termodinamicamente (l'eso) tramite equilibrio. Fu inoltre chiaro che l'alchene doveva essere accessibile da un 7-azabiciclo[2.2.l]eptan-2-one protetto (X = PG) tramite condensazione con la specie 5-metallo-2-cloropiridina.
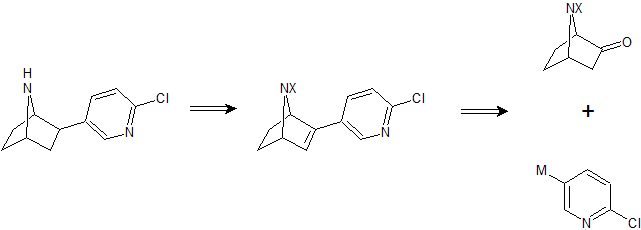 Un'efficace preparazione dell'endo-7-metil-7-azabiciclo[2.2.1]eptan-2-olo è stata riportata in precedenza e questa metodologia è stata utilizzata per preparare il 7-benzil derivato. La benzilazione dell'N-trifluoroacetilaminocicloes-3-ene in dimetilformammide (DMF) con sodio idruro come base aveva prodotto solo una modesta resa del derivato benzilato desiderato. Comunque, scaldando il trifluoroacetato in DMF a 70 °C con l'agente alchilante, in presenza di cesio carbonato, aveva prodotto il derivato benzoilato con una resa del 66%. Questo è stato trattato con acido m-cloroperbenzoico
(mCPBA) a dare una miscela di epossidi, che potevano essere separati tramite colonna cromatografica su gel di silice, usando dietile etere-esano come miscela eluente, ed il materiale che correva più velocemente si dimostrò essere il prodotto trans desiderato. Generalmente, comunque, la miscela veniva purificata parzialmente in maniera più conveniente a dare con una resa del 69% una 1:4 di isomeri cis/trans. La blanda idrolisi basica usando potassio carbonato in metanolo a t.a. portava quindi agli amino epossidi con una resa del 93%. La ciclizzazione dell'isomero trans veniva ottenuta con una resa del 64% scaldando in N-metilpirrolidinone a 180 °C per 18 h.
A questo punto il gruppo N-benzile veniva rimosso tramite idrogenolisi (H2, 45 psi) usando il catalizzatore di Pearlman in etanolo che conteneva HCl 5M (5% v/v). Per un'efficace debenzilazione, l'idrogenazione è stata condotta a 40 °C per 3 h dato che a t.a. dopo 9 h avveniva una conversione ad ammina con una resa del 60% solamente. L'N-Boc protezione veniva quindi introdotta usando (BOC)2O in soluzione di diossano-sodio idrossido a t.a.. L'alcole risultante veniva ossidato secondo le condizioni di ossidazione di Swern a dare il chetone richiesto per la reazione di coupling chiave.
Nonostante il 5-litio derivato della 2-cloropiridina non è stato riportato in precedenza, gli autori si aspettavano che potesse essere generato tramite metallazione della 2-cloro-5-iodopiridina. Il trattamento di questa con n-BuLi a - 70 °C seguito da quenching con il chetone ottenuto in precedenza forniva l'alcole desiderato con una resa del 58%. Nessuno dei prodotti derivati da metallazione di altre posizioni dell'anello della piridina vennero riscontrati. L'alcole terziario ottenuto veniva convertito ad S-metil xantato con resa quantitativa attraverso trattamento con potassio idruro e successivo quenching con disolfuro di carbonio e metile ioduro. La termolisi in toluene a riflusso per 2 h portava ad eliminazione senza intoppi dello xantato a dare l'olefina con una resa del 72%. L'idrogenazione di questo derivato in etile acetato (H2, 40 psi) usando il catalizzatore di Adams produceva una miscela 4:1 di isomeri endo/eso da cui il derivato eso desiderato, più polare veniva isolato con una resa del 16% tramite cromatografia su colonna su gel di silice usando etile acetato-esano come miscela eluente. L'isomero endo indesiderato veniva epimerizzato usando potassio tert-butossido in alcole tert-butilico a riflusso per 30 h a dare l'isomero eso con una resa complessiva elevata. La deprotezione dell'isomero eso N-Boc veniva condotta con resa quantitativa usando acido trifluoroacetico (TFA) a t.a. a dare l'epibatidina racema come solido incolore, che veniva caratterizzata come emi-ossalato.
Usando questa procedura poteva essere prodotto un materiale racemo nell'ordine dei grammi.
Un'efficace preparazione dell'endo-7-metil-7-azabiciclo[2.2.1]eptan-2-olo è stata riportata in precedenza e questa metodologia è stata utilizzata per preparare il 7-benzil derivato. La benzilazione dell'N-trifluoroacetilaminocicloes-3-ene in dimetilformammide (DMF) con sodio idruro come base aveva prodotto solo una modesta resa del derivato benzilato desiderato. Comunque, scaldando il trifluoroacetato in DMF a 70 °C con l'agente alchilante, in presenza di cesio carbonato, aveva prodotto il derivato benzoilato con una resa del 66%. Questo è stato trattato con acido m-cloroperbenzoico
(mCPBA) a dare una miscela di epossidi, che potevano essere separati tramite colonna cromatografica su gel di silice, usando dietile etere-esano come miscela eluente, ed il materiale che correva più velocemente si dimostrò essere il prodotto trans desiderato. Generalmente, comunque, la miscela veniva purificata parzialmente in maniera più conveniente a dare con una resa del 69% una 1:4 di isomeri cis/trans. La blanda idrolisi basica usando potassio carbonato in metanolo a t.a. portava quindi agli amino epossidi con una resa del 93%. La ciclizzazione dell'isomero trans veniva ottenuta con una resa del 64% scaldando in N-metilpirrolidinone a 180 °C per 18 h.
A questo punto il gruppo N-benzile veniva rimosso tramite idrogenolisi (H2, 45 psi) usando il catalizzatore di Pearlman in etanolo che conteneva HCl 5M (5% v/v). Per un'efficace debenzilazione, l'idrogenazione è stata condotta a 40 °C per 3 h dato che a t.a. dopo 9 h avveniva una conversione ad ammina con una resa del 60% solamente. L'N-Boc protezione veniva quindi introdotta usando (BOC)2O in soluzione di diossano-sodio idrossido a t.a.. L'alcole risultante veniva ossidato secondo le condizioni di ossidazione di Swern a dare il chetone richiesto per la reazione di coupling chiave.
Nonostante il 5-litio derivato della 2-cloropiridina non è stato riportato in precedenza, gli autori si aspettavano che potesse essere generato tramite metallazione della 2-cloro-5-iodopiridina. Il trattamento di questa con n-BuLi a - 70 °C seguito da quenching con il chetone ottenuto in precedenza forniva l'alcole desiderato con una resa del 58%. Nessuno dei prodotti derivati da metallazione di altre posizioni dell'anello della piridina vennero riscontrati. L'alcole terziario ottenuto veniva convertito ad S-metil xantato con resa quantitativa attraverso trattamento con potassio idruro e successivo quenching con disolfuro di carbonio e metile ioduro. La termolisi in toluene a riflusso per 2 h portava ad eliminazione senza intoppi dello xantato a dare l'olefina con una resa del 72%. L'idrogenazione di questo derivato in etile acetato (H2, 40 psi) usando il catalizzatore di Adams produceva una miscela 4:1 di isomeri endo/eso da cui il derivato eso desiderato, più polare veniva isolato con una resa del 16% tramite cromatografia su colonna su gel di silice usando etile acetato-esano come miscela eluente. L'isomero endo indesiderato veniva epimerizzato usando potassio tert-butossido in alcole tert-butilico a riflusso per 30 h a dare l'isomero eso con una resa complessiva elevata. La deprotezione dell'isomero eso N-Boc veniva condotta con resa quantitativa usando acido trifluoroacetico (TFA) a t.a. a dare l'epibatidina racema come solido incolore, che veniva caratterizzata come emi-ossalato.
Usando questa procedura poteva essere prodotto un materiale racemo nell'ordine dei grammi.
 Reagenti e condizioni (Bn = PhCH2): a, BnBr, DMF, Cs2CO3, 70 °C 18 h; b, m-CPBA, CH2Cl2, t.a., 4 h; c, K2CO3, MeOH, H2O, 3 d; d, N-metilpirrolidinone, 180 °C, 18 h; e, H2, 40 psi, 40 °C, EtOH, HCl 5M, Pd(OH)2/C (Pearlman's catalyst); f, (Boc)2O, NaOH 1M, diossano; g, (COCl)2, Et3N, Me2SO, CH2Cl2; h, n-BuLi (1 equiv), Et2O, THF, -70 °C; i, KH, THF, 0 oC ===> t.a.; j, CS2, MeI, 0 °C; k, toluene, 110 °C; l, PtO2, H2, 45 psi, EtOAc; m, t-BuOH, t-BuOK, 100 °C, 30 h; n, HCl, EtOAc.
Reagenti e condizioni (Bn = PhCH2): a, BnBr, DMF, Cs2CO3, 70 °C 18 h; b, m-CPBA, CH2Cl2, t.a., 4 h; c, K2CO3, MeOH, H2O, 3 d; d, N-metilpirrolidinone, 180 °C, 18 h; e, H2, 40 psi, 40 °C, EtOH, HCl 5M, Pd(OH)2/C (Pearlman's catalyst); f, (Boc)2O, NaOH 1M, diossano; g, (COCl)2, Et3N, Me2SO, CH2Cl2; h, n-BuLi (1 equiv), Et2O, THF, -70 °C; i, KH, THF, 0 oC ===> t.a.; j, CS2, MeI, 0 °C; k, toluene, 110 °C; l, PtO2, H2, 45 psi, EtOAc; m, t-BuOH, t-BuOK, 100 °C, 30 h; n, HCl, EtOAc.
I seguenti utenti ringraziano quimico per questo messaggio: TheChef, Max Fritz, Rusty, ENNIO VOCIRZIO, RhOBErThO
E' davvero affascinante.
Interessante lavoro per condurre a questa molecole, per le rane sicuramente è meglio!!
Affascinante davvero. A me fa molto riflettere il fatto che la Natura, e permettetemi la maiuscola, ci regali ogni giorno (o quasi) composti unici, davvero complessi, ed estremamente difficili da riprodurre. E usa molecole semplici, quasi banali all'occhio dell'uomo.
A me dispiace molto sia per le rane uccise per pochi decimi di milligrammo di epibatidina sia per gli esperimenti sul dolore condotti sui ratti. E questo mi fa riflettere. Se non testiamo sugli animali simili a noi dovremmo fare i test sugli umani. È più giusto testare su una cavia animale o su una umana che si è offerta volontariamente? E ce ne sono... Tipo in Svizzera. A me hanno chiesto di partecipare dietro compenso lauto a test, senza dirmi cosa testavano. Non ho mai accettato... Ho paura.
Tornando a noi. La sintesi da me messa è solo una parte dell'articolo. Previa risoluzione con il cloruro dell'acido di Mosher, ed in particolare usando l'isomero (R)-(-)-α-metossi-α-(trifluorometil)fenilacetil cloruro, dell'alcole protetto come N-Boc, si ottengono i due alcoli enantiomerici e quindi si giunge alla sintesi dei due enantiomeri dell'epibatidina, il (-) ed il (+). L'acido di Mosher è un agente derivatizzante chirale, e come detto serve a risolvere alcoli o amine tramite formazione di esteri o ammidi chirali, separabili tramite ad es. HPLC (con colonna chirale). Viene preferito il suo cloruro acilico in quanto più reattivo.

Ovviamente sono possibili altre vie di sintesi, che magari approfondirò prossimamente.
Grazie per la cortese attenzione 
Ma siamo sicuri che sul corpo umano fungano entrambi gli enantiomeri'?
E ancora, la raganella, produce un enantiomero in particolare o una miscela racema?
Sinceramente non so. Devo cercare.
Per quanto concerne la rana produce un solo enantiomero che è attivo, velenoso, quello eso.
L'endo non penso abbia attività... Ma sono solo miei ricordi.
Immaginavo, la natura solitamente produce un ben specifico isomero...
Comunque integra con altro, se ricordi, ch'è davvero interessante!!
Eccolo il batrace di cui si parla:
 Il suo nome scientifico deriva dal greco επίπεδο (terreno) + βάδος (cammino) ===> che cammina per terra.
L'epibatidina si rivelò come il primo analgesico non oppiaceo e come tale destò un notevolissimo interesse.
Presto si capì che non poteva essere usato per via dei suoi effetti collaterali legati all'elevata tossicità. Si cercò allora di modificarne la sua struttura molecolare al fine di sintetizzare uno o più composti di analoga efficacia ma senza averne la tossicità.
La tebaniclina è attualmente uno di questi composti sul quale si stanno effettuando approfonditi test clinici:
Il suo nome scientifico deriva dal greco επίπεδο (terreno) + βάδος (cammino) ===> che cammina per terra.
L'epibatidina si rivelò come il primo analgesico non oppiaceo e come tale destò un notevolissimo interesse.
Presto si capì che non poteva essere usato per via dei suoi effetti collaterali legati all'elevata tossicità. Si cercò allora di modificarne la sua struttura molecolare al fine di sintetizzare uno o più composti di analoga efficacia ma senza averne la tossicità.
La tebaniclina è attualmente uno di questi composti sul quale si stanno effettuando approfonditi test clinici:
 Quimico, la quantità di epibatidina originariamente estratta dalle rane mi risulta che fu nettamente più alta.
from New Scientist magazine, issue 1823 - 30 May 1992:
John Daly and his colleagues at the National Institutes of Health at Bethesda, Maryland, extracted 60 milligrams of material from a total of 750 frogs. They purified this using chromatography to obtain 24 milligrams of the new chemical.
saluti
Mario
Quimico, la quantità di epibatidina originariamente estratta dalle rane mi risulta che fu nettamente più alta.
from New Scientist magazine, issue 1823 - 30 May 1992:
John Daly and his colleagues at the National Institutes of Health at Bethesda, Maryland, extracted 60 milligrams of material from a total of 750 frogs. They purified this using chromatography to obtain 24 milligrams of the new chemical.
saluti
Mario
I seguenti utenti ringraziano Mario per questo messaggio: Max Fritz, quimico, Rusty
Buono a sapersi. La mia fonte riportava ciò  Mi fido di più della sua fonte. Grazie.
Mi fido di più della sua fonte. Grazie.
Immaginavo fossero arrivati a modificarne la struttura vista l'elevata tossicità.
Riporto una delle sintesi della tebaniclina. Interessante a mio avviso.

Lo sviluppo clinico della tebaniclina è stato arrestato da effetti collaterali a livello gastrointestinale.
Saluti.
I seguenti utenti ringraziano quimico per questo messaggio: al-ham-bic
Ovviamente nel prodotto finale il Boc non c'è  Me culpa. Ho scritto della deprotezione ma nella foga di disegnare non ho tolto il Boc
Me culpa. Ho scritto della deprotezione ma nella foga di disegnare non ho tolto il Boc  a breve rimedierò.
a breve rimedierò.
-Epibatidine_Structural_Formulae_V.1.svg/220px-(%2B)-Epibatidine_Structural_Formulae_V.1.svg.png)

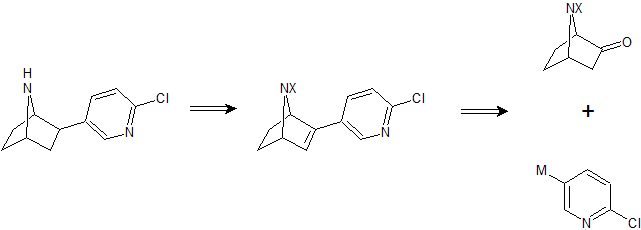 Un'efficace preparazione dell'endo-7-metil-7-azabiciclo[2.2.1]eptan-2-olo è stata riportata in precedenza e questa metodologia è stata utilizzata per preparare il 7-benzil derivato. La benzilazione dell'N-trifluoroacetilaminocicloes-3-ene in dimetilformammide (DMF) con sodio idruro come base aveva prodotto solo una modesta resa del derivato benzilato desiderato. Comunque, scaldando il trifluoroacetato in DMF a 70 °C con l'agente alchilante, in presenza di cesio carbonato, aveva prodotto il derivato benzoilato con una resa del 66%. Questo è stato trattato con acido m-cloroperbenzoico
(mCPBA) a dare una miscela di epossidi, che potevano essere separati tramite colonna cromatografica su gel di silice, usando dietile etere-esano come miscela eluente, ed il materiale che correva più velocemente si dimostrò essere il prodotto trans desiderato. Generalmente, comunque, la miscela veniva purificata parzialmente in maniera più conveniente a dare con una resa del 69% una 1:4 di isomeri cis/trans. La blanda idrolisi basica usando potassio carbonato in metanolo a t.a. portava quindi agli amino epossidi con una resa del 93%. La ciclizzazione dell'isomero trans veniva ottenuta con una resa del 64% scaldando in N-metilpirrolidinone a 180 °C per 18 h.
A questo punto il gruppo N-benzile veniva rimosso tramite idrogenolisi (H2, 45 psi) usando il catalizzatore di Pearlman in etanolo che conteneva HCl 5M (5% v/v). Per un'efficace debenzilazione, l'idrogenazione è stata condotta a 40 °C per 3 h dato che a t.a. dopo 9 h avveniva una conversione ad ammina con una resa del 60% solamente. L'N-Boc protezione veniva quindi introdotta usando (BOC)2O in soluzione di diossano-sodio idrossido a t.a.. L'alcole risultante veniva ossidato secondo le condizioni di ossidazione di Swern a dare il chetone richiesto per la reazione di coupling chiave.
Nonostante il 5-litio derivato della 2-cloropiridina non è stato riportato in precedenza, gli autori si aspettavano che potesse essere generato tramite metallazione della 2-cloro-5-iodopiridina. Il trattamento di questa con n-BuLi a - 70 °C seguito da quenching con il chetone ottenuto in precedenza forniva l'alcole desiderato con una resa del 58%. Nessuno dei prodotti derivati da metallazione di altre posizioni dell'anello della piridina vennero riscontrati. L'alcole terziario ottenuto veniva convertito ad S-metil xantato con resa quantitativa attraverso trattamento con potassio idruro e successivo quenching con disolfuro di carbonio e metile ioduro. La termolisi in toluene a riflusso per 2 h portava ad eliminazione senza intoppi dello xantato a dare l'olefina con una resa del 72%. L'idrogenazione di questo derivato in etile acetato (H2, 40 psi) usando il catalizzatore di Adams produceva una miscela 4:1 di isomeri endo/eso da cui il derivato eso desiderato, più polare veniva isolato con una resa del 16% tramite cromatografia su colonna su gel di silice usando etile acetato-esano come miscela eluente. L'isomero endo indesiderato veniva epimerizzato usando potassio tert-butossido in alcole tert-butilico a riflusso per 30 h a dare l'isomero eso con una resa complessiva elevata. La deprotezione dell'isomero eso N-Boc veniva condotta con resa quantitativa usando acido trifluoroacetico (TFA) a t.a. a dare l'epibatidina racema come solido incolore, che veniva caratterizzata come emi-ossalato.
Usando questa procedura poteva essere prodotto un materiale racemo nell'ordine dei grammi.
Un'efficace preparazione dell'endo-7-metil-7-azabiciclo[2.2.1]eptan-2-olo è stata riportata in precedenza e questa metodologia è stata utilizzata per preparare il 7-benzil derivato. La benzilazione dell'N-trifluoroacetilaminocicloes-3-ene in dimetilformammide (DMF) con sodio idruro come base aveva prodotto solo una modesta resa del derivato benzilato desiderato. Comunque, scaldando il trifluoroacetato in DMF a 70 °C con l'agente alchilante, in presenza di cesio carbonato, aveva prodotto il derivato benzoilato con una resa del 66%. Questo è stato trattato con acido m-cloroperbenzoico
(mCPBA) a dare una miscela di epossidi, che potevano essere separati tramite colonna cromatografica su gel di silice, usando dietile etere-esano come miscela eluente, ed il materiale che correva più velocemente si dimostrò essere il prodotto trans desiderato. Generalmente, comunque, la miscela veniva purificata parzialmente in maniera più conveniente a dare con una resa del 69% una 1:4 di isomeri cis/trans. La blanda idrolisi basica usando potassio carbonato in metanolo a t.a. portava quindi agli amino epossidi con una resa del 93%. La ciclizzazione dell'isomero trans veniva ottenuta con una resa del 64% scaldando in N-metilpirrolidinone a 180 °C per 18 h.
A questo punto il gruppo N-benzile veniva rimosso tramite idrogenolisi (H2, 45 psi) usando il catalizzatore di Pearlman in etanolo che conteneva HCl 5M (5% v/v). Per un'efficace debenzilazione, l'idrogenazione è stata condotta a 40 °C per 3 h dato che a t.a. dopo 9 h avveniva una conversione ad ammina con una resa del 60% solamente. L'N-Boc protezione veniva quindi introdotta usando (BOC)2O in soluzione di diossano-sodio idrossido a t.a.. L'alcole risultante veniva ossidato secondo le condizioni di ossidazione di Swern a dare il chetone richiesto per la reazione di coupling chiave.
Nonostante il 5-litio derivato della 2-cloropiridina non è stato riportato in precedenza, gli autori si aspettavano che potesse essere generato tramite metallazione della 2-cloro-5-iodopiridina. Il trattamento di questa con n-BuLi a - 70 °C seguito da quenching con il chetone ottenuto in precedenza forniva l'alcole desiderato con una resa del 58%. Nessuno dei prodotti derivati da metallazione di altre posizioni dell'anello della piridina vennero riscontrati. L'alcole terziario ottenuto veniva convertito ad S-metil xantato con resa quantitativa attraverso trattamento con potassio idruro e successivo quenching con disolfuro di carbonio e metile ioduro. La termolisi in toluene a riflusso per 2 h portava ad eliminazione senza intoppi dello xantato a dare l'olefina con una resa del 72%. L'idrogenazione di questo derivato in etile acetato (H2, 40 psi) usando il catalizzatore di Adams produceva una miscela 4:1 di isomeri endo/eso da cui il derivato eso desiderato, più polare veniva isolato con una resa del 16% tramite cromatografia su colonna su gel di silice usando etile acetato-esano come miscela eluente. L'isomero endo indesiderato veniva epimerizzato usando potassio tert-butossido in alcole tert-butilico a riflusso per 30 h a dare l'isomero eso con una resa complessiva elevata. La deprotezione dell'isomero eso N-Boc veniva condotta con resa quantitativa usando acido trifluoroacetico (TFA) a t.a. a dare l'epibatidina racema come solido incolore, che veniva caratterizzata come emi-ossalato.
Usando questa procedura poteva essere prodotto un materiale racemo nell'ordine dei grammi.
 Reagenti e condizioni (Bn = PhCH2): a, BnBr, DMF, Cs2CO3, 70 °C 18 h; b, m-CPBA, CH2Cl2, t.a., 4 h; c, K2CO3, MeOH, H2O, 3 d; d, N-metilpirrolidinone, 180 °C, 18 h; e, H2, 40 psi, 40 °C, EtOH, HCl 5M, Pd(OH)2/C (Pearlman's catalyst); f, (Boc)2O, NaOH 1M, diossano; g, (COCl)2, Et3N, Me2SO, CH2Cl2; h, n-BuLi (1 equiv), Et2O, THF, -70 °C; i, KH, THF, 0 oC ===> t.a.; j, CS2, MeI, 0 °C; k, toluene, 110 °C; l, PtO2, H2, 45 psi, EtOAc; m, t-BuOH, t-BuOK, 100 °C, 30 h; n, HCl, EtOAc.
Reagenti e condizioni (Bn = PhCH2): a, BnBr, DMF, Cs2CO3, 70 °C 18 h; b, m-CPBA, CH2Cl2, t.a., 4 h; c, K2CO3, MeOH, H2O, 3 d; d, N-metilpirrolidinone, 180 °C, 18 h; e, H2, 40 psi, 40 °C, EtOH, HCl 5M, Pd(OH)2/C (Pearlman's catalyst); f, (Boc)2O, NaOH 1M, diossano; g, (COCl)2, Et3N, Me2SO, CH2Cl2; h, n-BuLi (1 equiv), Et2O, THF, -70 °C; i, KH, THF, 0 oC ===> t.a.; j, CS2, MeI, 0 °C; k, toluene, 110 °C; l, PtO2, H2, 45 psi, EtOAc; m, t-BuOH, t-BuOK, 100 °C, 30 h; n, HCl, EtOAc.



 Mi fido di più della sua fonte. Grazie.
Mi fido di più della sua fonte. Grazie.
 Me culpa. Ho scritto della deprotezione ma nella foga di disegnare non ho tolto il Boc
Me culpa. Ho scritto della deprotezione ma nella foga di disegnare non ho tolto il Boc