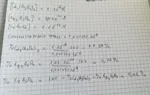alexus9_6
2017-08-31 09:27
Una soluzione contenente ioni Ag+ = 2,2 x 10^-4 M , Cd2+ = 2,8 x 10^-6 M , Cr3+ = 7,8 x 10^-7 M viene trattata con Na3AsO4 in eccesso . Stabilire la percentuale di separazione teoricamente ottenibile . Kps(Ag3AsO4) = 1,1 x 10^-22 , Kps[Cd3(AsO4)2] = 2,2 x 10^-33 , Kps(CrAsO4) = 7,8 x 10^-21 .
Mi scrivo le espressioni delle Kps per ciascun sale, ad es.:
Kps(Ag3AsO4) = [Ag+]^3 x [AsO4^3-]
e così via . Mi ricavo tre valori di [AsO4^3-] necessari a fare precipitare ciascun sale e ottengo:
[AsO4^3-]Cr3+ = 1 x 10^-14 M precipita per primo (in quanto raggiunge per primo la Kps)
[AsO4^3-]Ag+ = 1,03 x 10^-11 M precipita per secondo
[AsO4^3-]Cd2+ = 1 x 10^-8 M precipita per terzo
riconosco, dai valori dati, che precipita per primo il sale di Cromo ( CrAsO4 ), per secondo quello di Argento ( Ag3AsO4 ) e per ultimo quello di Cadmio ( Cd3(AsO4)2 ) .
Da qui in poi non so come proseguire per risolvere l'esercizio e calcolare la percentuale di separazione.
Mi aiutereste? Grazie!