claudia
2018-11-19 16:18
Salve, sto studiando gli acidi e le basi e mi è sorto un dubbio riguardante l'equilibrio.
Praticamente ci sono acidi e basi forti, questi ultimi tendono a dissociarsi completante in ioni in ambiente acquoso, mentre acidi e basi deboli tendono a dissociarsi parzialmente in ioni in ambiente acquoso; ossia una parte di molecola rimane indissociata, ciò genera un equilibrio indicato con doppia freccia.
L'equilibrio in generale indica che la velocità di una reazione diretta è uguale a quella inversa, ossia nella stessa unità di tempo la quantità di reagenti e uguale a quella dei prodotti.
Nel caso di reazioni acido-base, ci sta la seguente regola che non ho capito:
In una reazione acido base, la posizione dell'equilibrio favorisce la reazione dell'acido più forte con la base più forte per dare l'acido più debole e la base più debole. Acido e base deboli sono preponderanti all'equilibrio, ossia si tende ad andare verso acido e base debole.
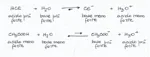
In pratica se ho:
HCl + acqua si formerà anione cloruro e ione idronio, in questo caso essendo HCl un acido forte la base coniugata Cl^- sarà debole, tenderà poco a trattenere un protone, così l'equilibrio andrà verso destra, ma non capisco se l'acqua è da considerarsi una base forte o debole in questo caso.
Grazie