lepre561
2018-07-20 16:09
ho capito che gli orbitali ibridi si formano per permettere ad alcuni atomi di formare più legami.
come ad esempio nel metano il carbonio che potrebbe legarsi a soli di atomi di idrogeno si lega a 4 atomi di idrogeno perchè si ibrida sp3.
il mio dubbio è perchè la'acqua si ibrida anche lei sp3?cioe l'ossigneo ha due elletroni spaiati cosi come sono due gli elettroni spaiati dell'idrogeno.
perchè non ha una struttura planare ma si ibrida e forma una geometria tetraedrica?
lepre561 ha scritto:
cioe l'ossigneo ha due elletroni spaiati cosi come sono due gli elettroni spaiati dell'idrogeno.
A parte gli errori di ortografia che si possono evitare o quantomeno correggere in seguito, quella che hai scritto è una grossa sciocchezza. 
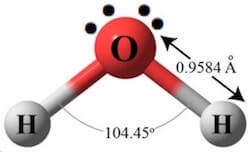
La configurazione elettronica dell'atomo di ossigeno è: 1s2 2s2 2p4, quindi ha 6 elettroni sull'ultimo livello, 2 di questi elettroni vengono utilizzati per formare due legami covalenti con due atomi di idrogeno, perciò sull'atomo di ossigeno rimangono 4 elettroni non condivisi che formano 2 coppie elettroniche non condivise.
La configurazione elettronica dell'atomo di idrogeno è: 1s1, quindi questo unico elettrone viene utilizzato per formare un legame covalente con l'atomo di ossigeno; su ciascun atomo di idrogeno non rimane alcun elettrone non condiviso.
La molecola dell'acqua possiede perciò 2 coppie elettroniche impegnate e 2 coppie elettroniche non condivise e la forma geometrica secondo la teoria VSEPR è quella tetraedrica: al centro del tetraedro ci sta l'atomo di ossigeno, sul vertice superiore ci sta una coppia elettronica non condivisa, sui tre vertici di base ci stanno una coppia non condivisa e due atomi di idrogeno. Non è un tetraedro regolare con angoli di legame di 109°28' come la molecola del CH4, ma è una forma angolare con angolo di 104°45' a causa della forte repulsione delle due coppie elettroniche non condivise.
I seguenti utenti ringraziano LuiCap per questo messaggio: Rosa, lepre561

