al-ham-bic
2012-05-03 21:46
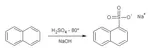
1-Naftalensulfonato sodico sintesi
In seguito alla interessante discussione scaturita riguardo la solfonazione del naftalene (ved. 2-naftalensulfonato sodico) ho provato la sintesi dell'isomero alfa, per verificare l'andamento della solfonazione operando in condizioni "cinetiche", ovvero sfruttando la velocità di reazione elevata a relativamente bassa temperatura rispetto all'andamento "termodinamico" di formazione dell'isomero beta preparato in precedenza.
La procedura ricalca fedelmente quella già proposta, ho solo ridotto di un fattore 2,5 le quantità dei reagenti, dato che si trattava di una verifica e non di una preparazione finalizzata a sintesi successive.
Materiale occorrente:
- naftalene
- acido solforico
- sodio idrossido
- sodio cloruro
- vetreria opportuna
- in un pallone da 250 ml introdurre 20 g di naftalene e riscaldare fino a fusione (80°), senza oltrepassare questa temperatura.
In una beuta da 50 ml preriscaldare contemporaneamente 18 ml di H2SO4 conc. alla stessa temperatura.
Ho fatto questo per evitare di dovere riscaldare ancora la miscela alla successiva aggiunta dell'acido freddo, affinchè sia possibile operare velocemente (mi ero posto il limite di due minuti complessivi).
In poche porzioni, agitando vigorosamente, aggiungere l'acido al naftalene fuso, tenendo sempre d'occhio il temometro immerso; se la miscela tende ad aumentare in temperatura raffreddare leggermente affinchè si mantenga nel range 80-85°.
Il naftalene tende a sublimare facilmente e nelle zone fredde del pallone si formerà uno straterello di sostanza sublimata, che non parteciperà alla reazione.
Trascorsi i due minuti complessivi dall'inizio dell'aggiunta di acido, versare subito in 250 ml di acqua fredda la miscela di H2SO4 residuo e di acido 1-naftalensulfonico formatosi.
La leggera torbidità è dovuta al naftalene non reagito, che comunque è molto poco; potrebbe essere dovuta anche a piccole quantità di dinaftilsulfone C10H7-SO2-C10H7 insolubile, ma non posso confermare che la sua formazione avvenga anche a temperatura così bassa. In ogni caso filtrare, ottenendo una soluzione solo leggermente opalescente.
Neutralizzare ora con NaOH al 20%; siccome c'è H2SO4 in eccesso ne serve una buona quantità e verso la fine procedere molto lentamente, senza far diventare basica la soluzione.
Procedere ora alla "salatura", per far precipitare la maggior quantità possibile del naftalensulfonato sodico; per far questo saturare con NaCl solido, mescolando fino a soluzione e poi aggiungere ulteriormente.
Scaldare fino a circa 80° eventualmente continuando ad aggiungere NaCl alla soluzione che a caldo rimane leggermente rosata ma quasi limpida.
Lasciando raffreddare si ha abbondante separazione di 1-naftalensulfonato sodico in microcristallini leggeri ma molto meno voluminosi rispetto all'isomero beta e purtroppo molto più solubili.
Filtrare su buchner spremendo il più possibile il prodotto, che rilascia l'acqua molto facilmente.
Lavare goccia a goccia con acqua molto fredda per eliminare il più possibile i cloruri e i solfati, che in ogni caso rimarranno in piccola quantità nel prodotto; non è possibile insistere più di tanto col lavaggio perchè questo naftalensulfonato come dicevo è ben solubile in acqua e continuando se ne perderebbe troppo.
Per lo stesso motivo non ho ricristallizzato da NaCl perchè non avrei guadagnato in purezza e ne avrei perso ancora.
Dopo il lavaggio lasciar seccare all'aria.
Il 1-naftalensulfonato sodico si presenta sotto forma di polvere microcritallina leggera che tende a impaccarsi di colore appena appena beige; non deve odorare per niente di naftalina.
Anche questa sintesi è abbastanza facile (attenzione alla T°!) ed è servita allo scopo prefissato (operazioni fast-soft...  .
.
La resa ottenuta è di 12 g, pari ad un misero 33%, che si spiega in grandissima parte per le perdite per solubilità e subordinatamente per il naftalene non reagito per vari motivi (che reputo intorno al 10-15%).
Purtroppo non ho alcun modo di verificare la purezza in isomero alfa rispetto al beta, ma avendo operato a temperatura appena sopra il punto di fusione e molto velocemente, probabilmente il beta stava ancora organizzandosi per farsi largo nell'ambiente che già la miscela solfonante è stata buttata in acqua; quindi dovrebbe essere in netta minoranza.
Almeno credo (e spero a ragione!) che sia andata così.
I seguenti utenti ringraziano al-ham-bic per questo messaggio: Chemistry4888, Rusty, Pomodoronda, Max Fritz, quimico, jobba, Dott.MorenoZolghetti, myttex




 Ciao PA!
Ciao PA!





 Mi sono segnato la sintesi, appena posso la provo.
Nel frattempo avrei un'altra domanda. Ci si chiedeva come mai si trova spesso la procedura per la sintesi del beta, e mai questa: ciò non potrebbe essere dovuto al fatto che la sintesi del prodotto beta è finalizzata poi alla produzione del 2-naftolo, per fusione alcalina, e che la stessa reazione applicata all'1-naftalensulfonato lo farebbe riarrangiare (per le questioni citate nell'altra discussione) sempre a 2-naftolo (passando magari per il 2-naftalensulfonato), senza possibilità di ottenere 1-naftolo per questa via?
Mi sono segnato la sintesi, appena posso la provo.
Nel frattempo avrei un'altra domanda. Ci si chiedeva come mai si trova spesso la procedura per la sintesi del beta, e mai questa: ciò non potrebbe essere dovuto al fatto che la sintesi del prodotto beta è finalizzata poi alla produzione del 2-naftolo, per fusione alcalina, e che la stessa reazione applicata all'1-naftalensulfonato lo farebbe riarrangiare (per le questioni citate nell'altra discussione) sempre a 2-naftolo (passando magari per il 2-naftalensulfonato), senza possibilità di ottenere 1-naftolo per questa via?





