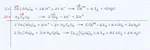vdb
2017-06-30 15:09
TESTO ESERCIZIO:
A 120mL di una soluzione 0.5M di acido ossalico, si aggiungono 2.205g di iodato di cerio (IV). La reazione porta alla formazione di ossalato di cerio (III), iodio e anidride carbonica. Ammettendo una resa di reazione del 90% calcolare:
a) i mL di anidride carbonica (misurati a c.n.) ottenuti nella reazione;
b) la molarità nella soluzione di ossalato di cerio (III) ottenuta.
Bilanciare la reazione con il metodo ionico-elettronico.
PROVA SOLUZIONE:
H2C2O4 + Ce(IO3)4 --> Ce(C2O4)3 + I2 +CO2
Ho due semireazioni di riduzione in cui I passa da n.o.=5 a I2 avente n.o.=0 e la seconda in cui Ce va da n.o.=4 a Ce2 con n.o.=3.
La semireazione di ossidazione è data dal carbonio che va da C con n.o.=3 nell'acido ossalico a CO2 dove il n.o.=4.
Red: (2I + 10e --> I2)*2
Red: (2Ce + 2e --> Ce2)*2
Ox: (C2 --> 2C + 2e)*12
Come posso andare avanti? Ci sono errori fin qui?
Ringrazio chiunque voglia aiutarmi.