Nexus
2010-07-11 14:39
Note di sicurezza: 1. Questa sintesi va effettuata in presenza di una buona ventilazione, idealmente sotto una cappa, per via degli abbondanti fumi acidi e gas NOx che si sviluppano! 2. Usare solo vetreria normalizzata ed esclusivamente in vetro! -------------------------------------------------------- Per produrre un pò di Luminol, mi sono fatto un pò di acido nitrico fumante, secondo il metodo del Salomone. Apparecchiatura: Montare un distillatore con un pallone da 500ml e una colonna Liebig il più efficiente possibile. Per l'alimentazione della colonna refrigerante, ho usato un miscuglio di acqua e ghiaccio. I raccordi vanno unti con grasso di silicone. Inserire un termometro normalizzato nel raccordo pallone-Liebig. Per la raccolta ho usato una beuta da 250ml immersa a sua volta in un bagno di acqua e ghiaccio. Procedimento: Il pallone viene caricato con 170g di nitrato di sodio anidro al quale si aggiungono 100g di acido solforico concentrato. Si forma una poltiglia semi-solida: con una bacchetta di vetro, cercare di amalgamare bene il tutto. A questo punto accendere l'acqua per il Liebig e montare il pallone nel distillatore; scaldarlo energicamente con un mantello riscaldante (io l'ho messo su 3/4). Dopo pochi minuti inizia a distillare l'acido nitrico, con lieve sviluppo di gas rossi. La temperatura del gas è di 85 Celsius e va ad aumentare. La reazione che avviene è 2NaNO[Sub]3[/Sub] + H[Sub]2[/Sub]SO[Sub]4[/Sub] ---> 2HNO[Sub]3[/Sub] + Na[Sub]2[/Sub]SO[Sub]4[/Sub] Quando iniziano a formarsi abbondanti gas rossi nel pallone di distillazione, la distillazione è terminata (a questo punto il termometro segnava 108 Celsius). Togliere il riscaldamento dal pallone, tappare l'acido nitrico vistosamente fumante così ottenuto e lasciar raffreddare l'apparecchiatura. La resa è stata di 48ml, corrispondenti a 70g (56% della resa teorica) La densità è di circa 1.47 g/ml
I seguenti utenti ringraziano Nexus per questo messaggio: Dott.MorenoZolghetti, Max Fritz, quimico, Nichel Cromo, jobba, -push-





 ).
).
 Io ho ancora molto da imparare e tanta esperienza e sicurezza da acquisire prima di cimentarmi in sintesi simili
Io ho ancora molto da imparare e tanta esperienza e sicurezza da acquisire prima di cimentarmi in sintesi simili 






 ) ho rinunciato, e ho ritentato con una seconda soluzione a concentrazione 1N, ottenuta con 10g di soda in 250ml di acqua. Questa titolazione l'ho fermata a causa di una mosca morta DENTRO la buretta (
) ho rinunciato, e ho ritentato con una seconda soluzione a concentrazione 1N, ottenuta con 10g di soda in 250ml di acqua. Questa titolazione l'ho fermata a causa di una mosca morta DENTRO la buretta ( ). Rifatta con la soda alla stessa concentrazione, ho trovato la concentrazione dell'acido uguale a 3N (avevo usato un totale di 61,3ml di soda). Non contento del risultato, oggi ho fatto un nuovo tentativo: questa volta ho disciolto un totale di 20g di soda in 250ml di acqua, e usato quindi una soluzione 2N.
). Rifatta con la soda alla stessa concentrazione, ho trovato la concentrazione dell'acido uguale a 3N (avevo usato un totale di 61,3ml di soda). Non contento del risultato, oggi ho fatto un nuovo tentativo: questa volta ho disciolto un totale di 20g di soda in 250ml di acqua, e usato quindi una soluzione 2N.








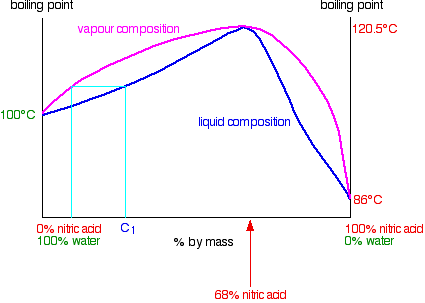








 )
)
 (so' che non è lui, ma un po' gli somiglia dai... ).
(so' che non è lui, ma un po' gli somiglia dai... ).
![[Corrosivo]](images/corrosivo.png)




