quimico
2011-12-15 09:28
1. Introduzione
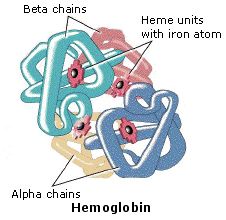
Le proteine, dal greco proteios, che significa primo, sono una classe di composti organici che sono presenti nelle cellule viventi e sono vitali per ognuna di esse. Sotto forma di pelle, capelli, callo, cartilagine, muscoli, tendini e legamenti, le proteine tengono assieme. proteggono, e forniscono una struttura al corpo di un organismo pluricellulare. Sotto forma di enzimi, ormoni, anticorpi, e globuline, essie catalizzano, regolano, e proteggono la chimica del corpo. Sotto forma di emoglobina, mioglobina e diverse lipoproteine, esse effettuano il trasporto di ossigeno e di altre sostanze all'interno dell'organismo.
Le proteine sono generalmente considerate benefiche, e sono una parte necessaria della dieta di tutti gli animali. Gli umani possono diventare gravemente ammalati se non mangiango abbastanza proteine idonee, una malattia nota come kwashiorkor, una forma estrema di carenza proteica. Gli antibiotici ed i vaccini basati sulle proteine aiutano a combattere la malattia, e noi scaldiamo e proteggiamo i nostri corpi cn vestiti e scarpe che spesso sono proteine in natura (lana, seta e cuoio).
Le proprietà mortali di tossine e veleni proteici è meno diffusamente apprezzata. La tossina botulinica di tipo A, dal Clostridium botulinum, è considerata come il più potente veleno conosciuto. Basandoci su studi tossicologici, un cucchiaino da tea di questa tossina dovrebbe essere sufficiente ad uccidere 1/5 edella popolazione mondiale. Le tossine prodotte dai microorganismi Clostridium tetani e Corynebacterium diphtheriae sono quasi velenosi come il citato Clostridium botulinum. Una lista di proteine o peptidi altamente tossici dovrebbe anche includere il veleno di molti serpenti, ed la ricina, la proteina tossica ritrovata nei semi del Ricinus communis.
Nonostante la varietà della loro funzione fisiologica e le differenze in proprietà fisiche — la seta è una fibra flessibile, il corno è un solido abbastanza rigido, e l'enzima pepsina cristalli solubili in acqua — le proteina sono sufficientemente simili nella struttura molecolare per assicurare il trattamento di esse come una unica famiglia chimica. Quando comparate ai carboidrati ed ai lipidi, le proteine sono ovviamente differenti nella composizione fondamentale. I lipidi sono per lo più idrocarburi in natura, essendo generalmente composti dal 75 all'85% di carbonio. I carboidrati sono circa al 50% costituiti da ossigeno, e come i lipidi, di solito hanno meno del 5% di azoto (spesso neanche questo). Le proteine ed i peptidi, dall'altro lato, sono composti dal 15 al 25% di azoto e circa dalla medesima quantità di ossigeno. La distinzione tra proteine e peptidi è la loro dimensione. I peptidi sono in un certo senso piccole proteina, avendo pesi molecolari inferiori a 10000.
2. α-Aminoacidi naturali
L'idrolisi delle proteine tramite acido o base acquosa ad ebollizione porta ad un assortimento di piccole molecole identificate come acidi α-aminocarbossilici. Più di venti di tali componenti sono stati isolati, e i più comuni di questi sono elencati nella tabella sotto. Quegli aminoacidi aventi nomi colorati in verde sono componenti essenziali della dieta, dato che essi NON sono sintetizzati tramite processi metabolici umani. La migliore fonte alimentare di questi nutrienti è la proteina, ma è importante riconoscere che non tutte le proteina hanno un uguale valore nutrizionale.
Per esempio, le arachidi hanno un contenuto in peso di proteina maggiore del pesce o delle uova, ma la proporzione di amino acidi essenziale nella parte proteica delle arachidi è solo 1/3 di quella derivata dalle due altre fonti. Per ragioni che diventaranno evidenti quando parleremo della struttura delle proteine e dei peptidi, ad ogni aminoacido viene assegnato una abbreviazione di una o tre lettere.
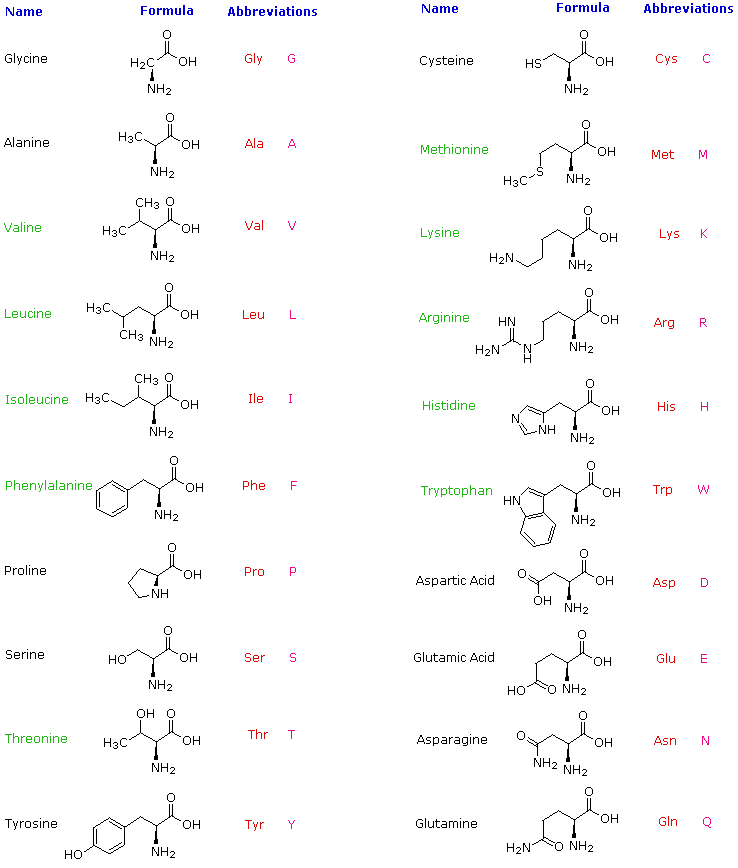
Alcune caratteristiche comuni di questi aminoacidi dovrebbero essere note. Con l'eccezione della prolina, essi sono tutti amine primarie; e con l'eccezione della glicina, sono tutti chirali. Le configurazioni degli aminoacidi chirali sono le stesse quando scritte con la formula di proiezione di Fischer, come nel disegno sotto, e questa era definita come la configurazione L da Fischer.

Il sostituente R in questa struttura è il componente strutturale rimanente che varia da un aminoacido ad un altro, e nella prolina R è un catena a tre carboni che unisce l'azoto al carbonio α in un anello a cinque membri. Applicando la notazione di Cahn-Ingold-Prelog, tutti questi aminoacidi naturali chirali, con l'eccezione della cisteina, hanno una configurazione S.
Per i primi sette composti nella colonna di sinistra il sostituente R è un idrocarburo. Le ultime tre voci nella colonna di sinistra hanno gruppi funzionali idrossile, e i primi due aminoacidi nella colonna di destra incorporano gruppi tiolo e solfuro rispettivamente. Lisina ed arginina hanno funzioni aminiche basiche nelle loro catene laterali; istidina e triptofano hanno anelli eterociclici azotati meno basici come sostituenti. Infine, le catene laterali acidi carbossilici sono sostituenti sull'acido aspartico e glutamico, e gli ultimi due composti nella colonna di destra sono le loro ammidi corrispondenti.
Le formule per gli aminoacidi scritte sopra sono semplici rappresentazioni di legami covalenti basate su precedenti conoscenze di analoghi monofunzionali. Le formule sono infatti sbagliate. Questo è evidente dalla comparazione delle proprietà fisiche di alcuni composti: acido isobutirrico, acido lattico, 3-amino-2-butanolo ed alanina. Tutti e quattro i composti sono all'incirca della stessa dimensione, ed hanno tutti solubilità in acqua da moderata ad eccellente. I primi due sono semplici acidi carbossilici, ed il terzo un amino alcole. Tutti e tre i composti sono solubili in solventi organici (etere ad esempio) ed hanno m.p. relativamente bassi. Gli acidi carbossilici hanno pKa vicine a 4.5, e l'acido coniugato dell'amina ha una pKa di 10. Il semplice aminoacido alanina è l'ultimo esempio. Per contrasto, ha un elevato m.p. (con decomposizione), è insolubole in solventi organici, ed è un acido un milione di volte più debole degli acidi carbossilici ordinari.
Queste differenze tutte puntano alla formazione di un sale interno tramite transfer di protone dalla funzione carbossilica acida al gruppo amino basico. La risultante struttura ammonio carbossilato, comunemente nota come zwitterione, è supportata anche dalle caratteristiche spettroscopiche dell'alanina.
CH3CH(NH2)CO2H  CH3CH(NH3)+CO2–
CH3CH(NH3)+CO2–
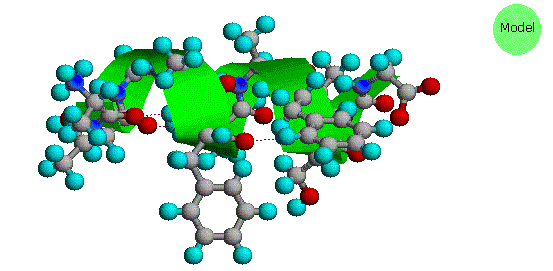
Come previsto dal suo carattere ionico, lo zwitterione alanina ha un elevato m.p., è insolubile in solventi non polari ed ha la forza acida di uno ione ammonio primario. Notate che nella lisina la funzione amina più lontana dal gruppo carbossile è più basica dell'amina α. Di conseguenza, la metà ammonio caricata positivamente formata all'estremità terminale della catena è attratta dal carbossilato negativo, col risultato che tale aminoacido assume una conformazione ad elica o spirale.
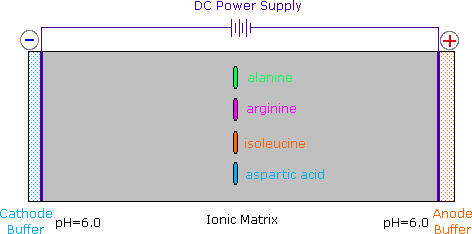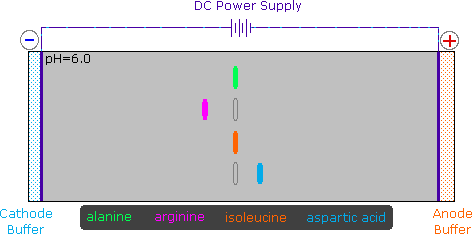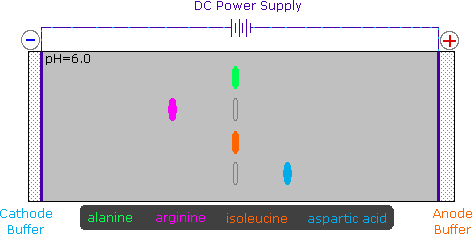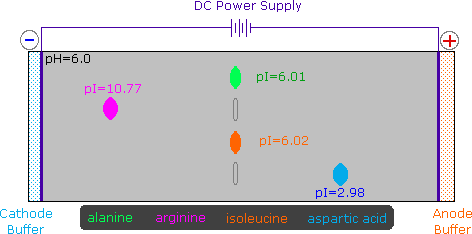
Dato che gli aminoacidi, così come i peptidi e le proteine, incorporano gruppi funzionali sia acidi che basici, la specie molecolare predominante presente in una soluzione acquosa dipenderà dal pH della soluzione. Allo scopo di determinare la natura delle specie molecolari e ioniche che sono presenti in soluzioni acquose a differenti pH, utilizziamo l'equazione di Henderson - Hasselbalch, scritta sotto. Qui, i pKa rappresentano l'acidità di una funzione specifica acido coniugato (HA). Quando il pH della soluzione eguaglia il pKa, le concentrazioni di HA ed A– devono essere uguali (log 1 = 0).
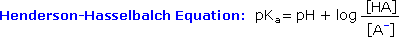
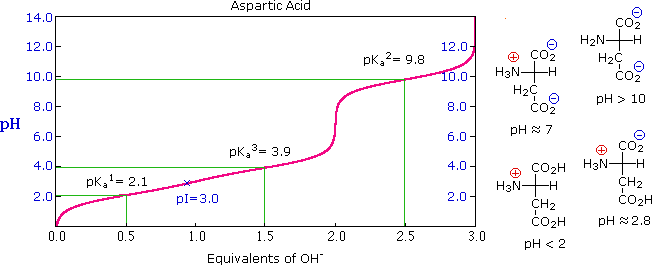
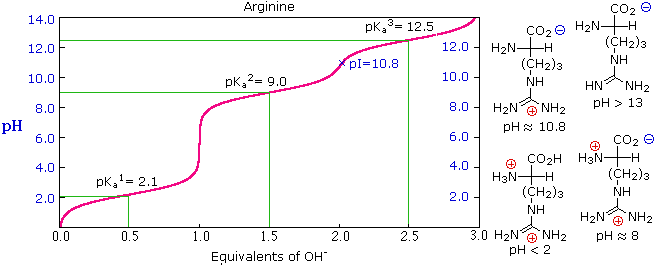
La curva di titolazione per l'alanina, mostrata sotto, dimostra questra relazione. Ad un pH < 2, sia la funzione carbossilato che la funzione amina sono protonate, così la molecola di alanina ha un netta carica positiva. Ad un pH > 10, l'amina esiste come base neutra ed il carbossile come sua base coniugata, così la molecola di alanina ha un netta carica negativa. A pH intermedi la concentrazione dello zwitterione aumenta, e ad un pH caratteristico, chiamato il punto isoelettrico (pI), le specie molecolari negativamente e positivamente cariche sono presenti in concentrazione eguale. Questo comportamente è generale per aminoacidi semplici (difunzionali). Partendo da uno stato completamente protonato, la variazione di pKa delle funzioni acide varia da 1.8 a 2.4 per il –CO2H, e da 8.8 a 9.7 for –NH3+. I punti isoelettrici variano da 5.5 a 6.2. Le curve di titolazione mostrano la neutralizzazione di questi acidi tramite basi aggiunte, ed il cambiamentodi pH durante la titolazione.
Le curve di titolazione per molti altri aminoacidi possono essere esaminate cliccando sul link qui riportato The University of Virginia in Charlottesville.
I seguenti utenti ringraziano quimico per questo messaggio: jobba, ClaudioG.
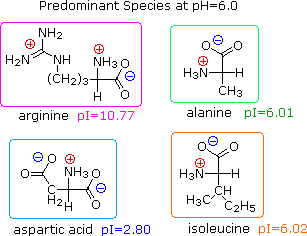
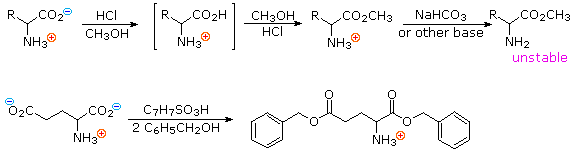
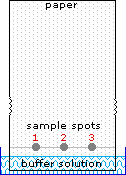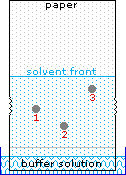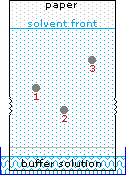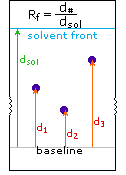
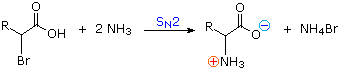 2) Modificando l'azoto come sale della ftalimmide, la tendenza delle amine di subire sostituzioni multiple è eliminata, ed avviene una singola pulita reazione di sostituzione di alogenuri primari e di molti alogenuri secondari. Questa procedura, nota come sintesi di Gabriel, può essere usata per trarre vantaggio nell'aminazione degli esteri bromomalonici, come mostrato nell'equazione superiore del seguente schema. Dato che l'estere malonico sostituito con la ftalimmide ha un idrogeno acido (colorato in arancione), attivato da due gruppi estere, questo intermedio può essere convertito in un anione ambidentato ed alchilato. Infine, l'idrolisi base catalizzata della metà ftalimmide e degli esteri, seguita da acidificazione e decarbossilazione termica, produce un aminoacido e l'acido ftalico (non mostrato qui).
2) Modificando l'azoto come sale della ftalimmide, la tendenza delle amine di subire sostituzioni multiple è eliminata, ed avviene una singola pulita reazione di sostituzione di alogenuri primari e di molti alogenuri secondari. Questa procedura, nota come sintesi di Gabriel, può essere usata per trarre vantaggio nell'aminazione degli esteri bromomalonici, come mostrato nell'equazione superiore del seguente schema. Dato che l'estere malonico sostituito con la ftalimmide ha un idrogeno acido (colorato in arancione), attivato da due gruppi estere, questo intermedio può essere convertito in un anione ambidentato ed alchilato. Infine, l'idrolisi base catalizzata della metà ftalimmide e degli esteri, seguita da acidificazione e decarbossilazione termica, produce un aminoacido e l'acido ftalico (non mostrato qui).
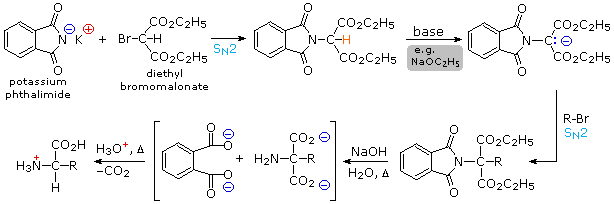 3) Un'elegante procedura, nota come sintesi di Strecker, assembla un α-aminoacid da ammoniaca (il precursore dell'amina), ione cianuro (il precursore del carbossile), ed un'aldeide. Questa reazione (mostrata sotto) è essenzialmente l'analogo imminico della formazione di una cianoidrina. L'α-amino nitrile formato in quetso modo può quindi essere idrolizzato in un aminoacido tramite catalisi acida o basica.
3) Un'elegante procedura, nota come sintesi di Strecker, assembla un α-aminoacid da ammoniaca (il precursore dell'amina), ione cianuro (il precursore del carbossile), ed un'aldeide. Questa reazione (mostrata sotto) è essenzialmente l'analogo imminico della formazione di una cianoidrina. L'α-amino nitrile formato in quetso modo può quindi essere idrolizzato in un aminoacido tramite catalisi acida o basica.
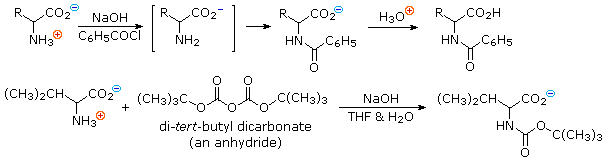
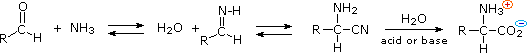 4) Risoluzione Le tre procedure descritte sopra, e molte altre che possono essere concepite, danno come prodotti degli aminoacidi racemi.
Se sono desiderati enantiomeri puri L o D, è necessario risolvere queste miscele racemiche. Un metodo comune di risoluzione dei racemi è tramite la formazione del sale diastereoisomerico con un acido o un base pura chirale. Questo viene illustrato per un aminoacido generico nel seguente schema. State attenti nel distinguere i simboli di carica, mostrati nei cerchi colorati, dai segni di rotazione ottica, mostrati tra parentesi!
Nel primo schema, sotto, la funzione acido carbossilico contribuisce alla formazione del sale diastereoisomerico. L'aminoacido racemo è prima convertito in una benzammide per rimuovere il carattere basico del gruppo amino. Poi, viene formato un sale di ammonio tramite combinazione dell'acido carbossilico con un'amina otticamente pura, come la brucina (correlata alla stricnina, anch'essa usata per risolvere acidi racemi). La struttura di questa amina non è mostrata, perché non è un fattore critico nella progressione logica dei passaggi. Dato che la metà aminoacido è racema e la base è un singolo enantiomero (levorotatorio in questo esempio), una miscela equimolare di sali diastereoisomerici viene formata (disegnata nel riquadro verde ombreggiato). I diastereoisomeri possono essere separati tramite cristallizzazione, cromatografia o un'altra manipolazione fisica, ed in questo modo uno degli isomeri può essere isolato per il trattamento successivo, in questa illustrazione è il diastereoisomero (+) : (−). Infine il sale viene rotto per trattamento acido, dando il (+)-aminoacido risolto assieme all'agente risolvente recuperato (l'amina otticamente attiva). Ovviamente, la stessa procedura può essere usata per ottenere l'enantiomero (−) dell'aminoacido.
4) Risoluzione Le tre procedure descritte sopra, e molte altre che possono essere concepite, danno come prodotti degli aminoacidi racemi.
Se sono desiderati enantiomeri puri L o D, è necessario risolvere queste miscele racemiche. Un metodo comune di risoluzione dei racemi è tramite la formazione del sale diastereoisomerico con un acido o un base pura chirale. Questo viene illustrato per un aminoacido generico nel seguente schema. State attenti nel distinguere i simboli di carica, mostrati nei cerchi colorati, dai segni di rotazione ottica, mostrati tra parentesi!
Nel primo schema, sotto, la funzione acido carbossilico contribuisce alla formazione del sale diastereoisomerico. L'aminoacido racemo è prima convertito in una benzammide per rimuovere il carattere basico del gruppo amino. Poi, viene formato un sale di ammonio tramite combinazione dell'acido carbossilico con un'amina otticamente pura, come la brucina (correlata alla stricnina, anch'essa usata per risolvere acidi racemi). La struttura di questa amina non è mostrata, perché non è un fattore critico nella progressione logica dei passaggi. Dato che la metà aminoacido è racema e la base è un singolo enantiomero (levorotatorio in questo esempio), una miscela equimolare di sali diastereoisomerici viene formata (disegnata nel riquadro verde ombreggiato). I diastereoisomeri possono essere separati tramite cristallizzazione, cromatografia o un'altra manipolazione fisica, ed in questo modo uno degli isomeri può essere isolato per il trattamento successivo, in questa illustrazione è il diastereoisomero (+) : (−). Infine il sale viene rotto per trattamento acido, dando il (+)-aminoacido risolto assieme all'agente risolvente recuperato (l'amina otticamente attiva). Ovviamente, la stessa procedura può essere usata per ottenere l'enantiomero (−) dell'aminoacido.
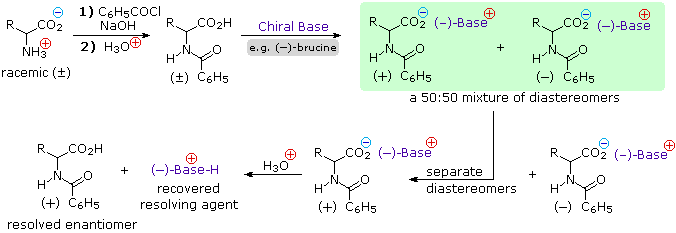 Dato che gli aminoacids sono anfoteri, la risoluzione ppotrebbe anche essere ottenuta sfruttando il carattere basico della funzione amino. Per questo approccio avremmo bisogno di un acido chirale enantiomericamente puro come l'acido tartarico per usarlo come agente risolvente.
Dato che gli aminoacids sono anfoteri, la risoluzione ppotrebbe anche essere ottenuta sfruttando il carattere basico della funzione amino. Per questo approccio avremmo bisogno di un acido chirale enantiomericamente puro come l'acido tartarico per usarlo come agente risolvente.
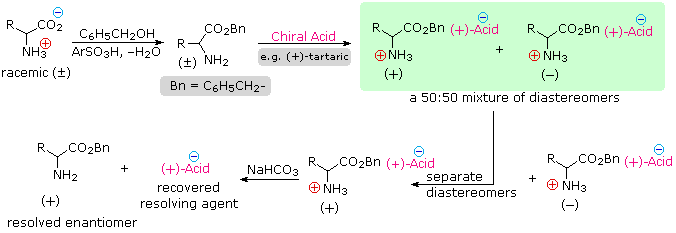 Nello schema sopra, questa strategia risolutiva alternativa viene illustrata. Notate che la funzione acido carbossilico è prima esterificata, così che essa non competerà con l'acido risolvente.
La risoluzione di derivati degli aminoacidi può anche essere ottenuta tramite discriminazione enzimatica nell'idrolisi di ammidi. Per esempio, un enzima aminoacilasi ricavato dai reni del maiale scinde un derivato ammidico di un L-aminoacido naturale più velocemente di quanto non accada con l'enantiomero D. Se la miscela racema di ammidi mostrate nel riquadro verde ombreggiato venisse trattata con questo enzima, l'enantiomero L (qualunque sia la sua rotazione) sarebbe rapidamente convertito nella sua forma zwitterionica libera, mentre l'enantiomero D rimarrebbe in larga parte immutato. Qui, le specie diastereoisomeriche sono stati di transizione più che intermedi isolabili. Questa separazione di enantiomeri, basata su velocità di reazione molto differenti, viene chiamata risoluzione cinetica.
Nello schema sopra, questa strategia risolutiva alternativa viene illustrata. Notate che la funzione acido carbossilico è prima esterificata, così che essa non competerà con l'acido risolvente.
La risoluzione di derivati degli aminoacidi può anche essere ottenuta tramite discriminazione enzimatica nell'idrolisi di ammidi. Per esempio, un enzima aminoacilasi ricavato dai reni del maiale scinde un derivato ammidico di un L-aminoacido naturale più velocemente di quanto non accada con l'enantiomero D. Se la miscela racema di ammidi mostrate nel riquadro verde ombreggiato venisse trattata con questo enzima, l'enantiomero L (qualunque sia la sua rotazione) sarebbe rapidamente convertito nella sua forma zwitterionica libera, mentre l'enantiomero D rimarrebbe in larga parte immutato. Qui, le specie diastereoisomeriche sono stati di transizione più che intermedi isolabili. Questa separazione di enantiomeri, basata su velocità di reazione molto differenti, viene chiamata risoluzione cinetica.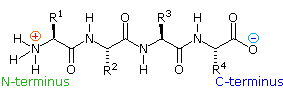
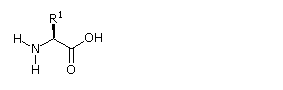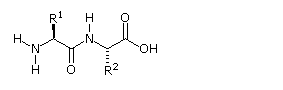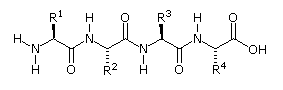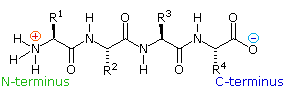
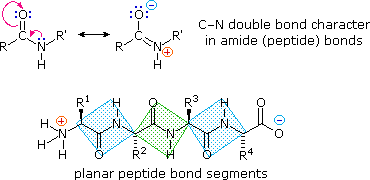
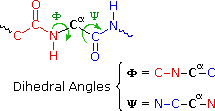
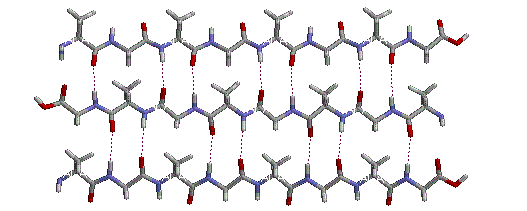
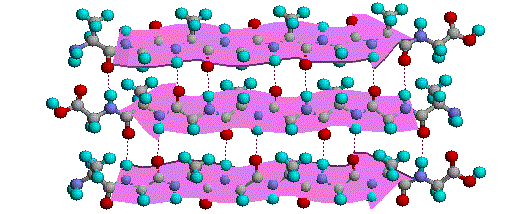
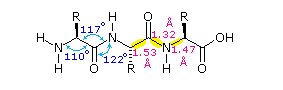 La flessibilità conformazionale delle catene peptidiche è principalmente limitata dalle rotazioni attorno ai legami che portano gli atomi di carbonio α. Questa restrizione è a causa della natura rigida del legame ammidico (peptidico). Come mostrato nello schema seguente, la delocalizzazione della coppia elettronica dell'azoto nel gruppo carbonilico porta ad un significativo carattere di doppio legame tra il carbonio carbonilico e l'azoto. Questo mantiene i legami peptidici relativamente planari e resistenti al cambiamento conformazionale. I rettangolo ombreggiati nella struttura inferiore definiscono queste regioni, ed identificano le rotazioni relativamente facili che posso avvenire dove gli angoli si incontrano (cioè al carbonio α). Questo aspetto della struttura peptidica è un importante fattore che influenza le conformazioni adottate dalle proteina e dai grandi peptidi.
La flessibilità conformazionale delle catene peptidiche è principalmente limitata dalle rotazioni attorno ai legami che portano gli atomi di carbonio α. Questa restrizione è a causa della natura rigida del legame ammidico (peptidico). Come mostrato nello schema seguente, la delocalizzazione della coppia elettronica dell'azoto nel gruppo carbonilico porta ad un significativo carattere di doppio legame tra il carbonio carbonilico e l'azoto. Questo mantiene i legami peptidici relativamente planari e resistenti al cambiamento conformazionale. I rettangolo ombreggiati nella struttura inferiore definiscono queste regioni, ed identificano le rotazioni relativamente facili che posso avvenire dove gli angoli si incontrano (cioè al carbonio α). Questo aspetto della struttura peptidica è un importante fattore che influenza le conformazioni adottate dalle proteina e dai grandi peptidi.
 2. La struttura primaria dei peptidi
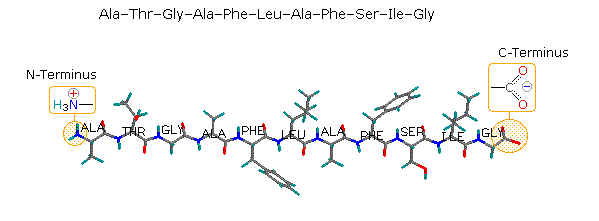
Poiché la parte N-terminale di una catena peptidica è distinta da quella C-terminale, un piccolo peptide composta di diversi aminoacidi può avere diversi isomeri costituzionali. Per esempio, un dipeptide formato da due diversi aminoacidi può avere due strutture differenti. Perciò, l'acido aspartico (Asp) e la fenilalanina (Phe) possono essere combinati per produrre Asp-Phe o Phe-Asp, ricordando che l'aminoacido sualls sinistra è quello N-terminale. Il metil estere del primo dipeptide (struttura sotto) è il dolcificante artificiale aspartame, che è circa 200 volte più dolce del saccarosio.
2. La struttura primaria dei peptidi
Poiché la parte N-terminale di una catena peptidica è distinta da quella C-terminale, un piccolo peptide composta di diversi aminoacidi può avere diversi isomeri costituzionali. Per esempio, un dipeptide formato da due diversi aminoacidi può avere due strutture differenti. Perciò, l'acido aspartico (Asp) e la fenilalanina (Phe) possono essere combinati per produrre Asp-Phe o Phe-Asp, ricordando che l'aminoacido sualls sinistra è quello N-terminale. Il metil estere del primo dipeptide (struttura sotto) è il dolcificante artificiale aspartame, che è circa 200 volte più dolce del saccarosio.
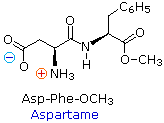 Nessuno degli aminoacidi componenti è dolce (Phe è in realtà amara), e i derivati dell'altro dipeptide (Phe-Asp) non sono dolci.
Un tripeptide composto di tre aminoacidi può essere costruito in 6 diversi modi (isomeri costituzionali), e il tetrapeptide mostrato sopra (composto di quattro diversi aminoacidi) dovrebbe avere 24 isomeri costituzionali. Quando tutti e venti gli aminoacidi naturali sono possibili componenti di un peptide, le combinazioni possibili sono enormi. La semplice probabilità statistica indica che il decapeptide formato da tutte le possibili combinazioni di questi aminoacidi dovrebbe totalizzare 2010 isomeri costituzionali!
I peptidi naturali di complessità variante sono abbondanti.
Il semplice e variamente distribuito tripeptide glutatione (prima voce nell'elenco sotto), è interessante perché la funzione carbossilica in catena laterale dell'acido glutamico N-terminale viene usato per il legame peptidico.
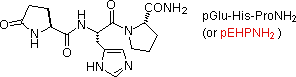
Un acido glutamico N-terminale può anche essere simile ad un lattame, come nel caso del TRH (seconda voce). L'abbreviazione per questa unità trasformata è pGlu (o pE), dove p sta per "piro" (tali chiusure d'anello avvengono spesso per riscaldamento).
I peptidi più grandi nell'elenco spesso dimostrano l'importanza delle abbreviazioni di aminoacidi usate, dato che una formula strutturale completa per un nonapeptide (o più grande) si dimostrebbe complessa ed inefficiente. Le formule che usano abbreviazioni letterali sono colorate in rosso.
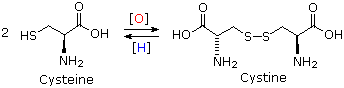
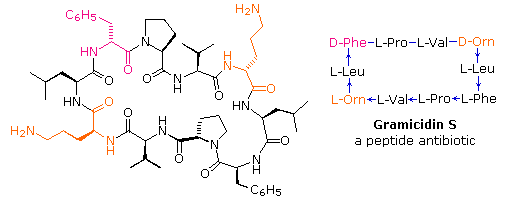
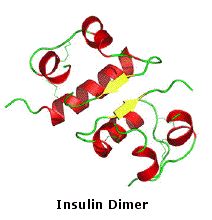
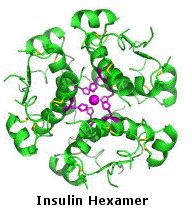
I dieci peptidi elencati fanno uso di tutti e venti gli aminoacidi comuni. Notate che l'unità C-terminale ha la forma di una ammide in alcuni casi (TRH, angiotensina & ossitocina). Quando duo o più cisteine sono presenti nella catena peptidica, essono sono spesso unite tramite legami disolfuro (ossitocina & endotelina); e nel caso dell'insulina, due catene peptidiche separate (A & B) sono tenute assieme da tali connessioni.
Alcuni peptidi naturali comuni
• Glutatione (3 residui): si ritrova nella maggior parte delle cellule viventi, stimola la crescita dei tessuti; ha sequenza aminoacidica +H3NCH(CO2–CH2CH2CONHCH(CH2SH)CONHCH2CO2H, γ-Glu-Cys-Gly (o γECG)
• TRH (3 residui): neuroormone ipotalamico, governa il rilascio di tirotropina
Nessuno degli aminoacidi componenti è dolce (Phe è in realtà amara), e i derivati dell'altro dipeptide (Phe-Asp) non sono dolci.
Un tripeptide composto di tre aminoacidi può essere costruito in 6 diversi modi (isomeri costituzionali), e il tetrapeptide mostrato sopra (composto di quattro diversi aminoacidi) dovrebbe avere 24 isomeri costituzionali. Quando tutti e venti gli aminoacidi naturali sono possibili componenti di un peptide, le combinazioni possibili sono enormi. La semplice probabilità statistica indica che il decapeptide formato da tutte le possibili combinazioni di questi aminoacidi dovrebbe totalizzare 2010 isomeri costituzionali!
I peptidi naturali di complessità variante sono abbondanti.
Il semplice e variamente distribuito tripeptide glutatione (prima voce nell'elenco sotto), è interessante perché la funzione carbossilica in catena laterale dell'acido glutamico N-terminale viene usato per il legame peptidico.
Un acido glutamico N-terminale può anche essere simile ad un lattame, come nel caso del TRH (seconda voce). L'abbreviazione per questa unità trasformata è pGlu (o pE), dove p sta per "piro" (tali chiusure d'anello avvengono spesso per riscaldamento).
I peptidi più grandi nell'elenco spesso dimostrano l'importanza delle abbreviazioni di aminoacidi usate, dato che una formula strutturale completa per un nonapeptide (o più grande) si dimostrebbe complessa ed inefficiente. Le formule che usano abbreviazioni letterali sono colorate in rosso.
I dieci peptidi elencati fanno uso di tutti e venti gli aminoacidi comuni. Notate che l'unità C-terminale ha la forma di una ammide in alcuni casi (TRH, angiotensina & ossitocina). Quando duo o più cisteine sono presenti nella catena peptidica, essono sono spesso unite tramite legami disolfuro (ossitocina & endotelina); e nel caso dell'insulina, due catene peptidiche separate (A & B) sono tenute assieme da tali connessioni.
Alcuni peptidi naturali comuni
• Glutatione (3 residui): si ritrova nella maggior parte delle cellule viventi, stimola la crescita dei tessuti; ha sequenza aminoacidica +H3NCH(CO2–CH2CH2CONHCH(CH2SH)CONHCH2CO2H, γ-Glu-Cys-Gly (o γECG)
• TRH (3 residui): neuroormone ipotalamico, governa il rilascio di tirotropina
 • Angiotensina II (8 residui): agente in grado di aumentare la pressione sanguigna, agisce sulla ghiandola surrenale; ha sequenza aminoacidica Asp-Arg-Val-Tyr-Ile-His-Pro-PheNH2 (o DRVYIHPFNH2)
• Bradichinina (9 residui): vasodilatatore ipotensivo, agisce sul muscolo liscio; ha sequenza aminoacidica: Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg (o RPPGFSPFR)
• Ossitocina (9 residui): ormone che contrae l'utero, stimola anche la produzione di latte
• Angiotensina II (8 residui): agente in grado di aumentare la pressione sanguigna, agisce sulla ghiandola surrenale; ha sequenza aminoacidica Asp-Arg-Val-Tyr-Ile-His-Pro-PheNH2 (o DRVYIHPFNH2)
• Bradichinina (9 residui): vasodilatatore ipotensivo, agisce sul muscolo liscio; ha sequenza aminoacidica: Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg (o RPPGFSPFR)
• Ossitocina (9 residui): ormone che contrae l'utero, stimola anche la produzione di latte
 • Somatostatina (14 residui): inibisce il rilascio dell'ormone della crescita, usata per il trattamento delle ulcere
• Somatostatina (14 residui): inibisce il rilascio dell'ormone della crescita, usata per il trattamento delle ulcere
 • Endotelina (21 residui): potente vasocostrittore, strutturalmente simile ad alcuni veleni di serpenti
• Endotelina (21 residui): potente vasocostrittore, strutturalmente simile ad alcuni veleni di serpenti
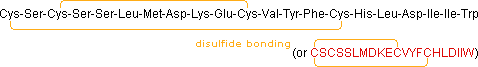 • Melittina (26 residui): veleno dell'ape domestica, usata per il trattamento dei reumatismi; ha sequenza aminoacidica: Gly-Ile-Gly-Ala-Val-Leu-Lys-Val-Leu-Thr-Thr-Gly-Leu-Pro~
~Ala-Leu-Ile-Ser-Trp-Ile-Lys-Arg-Lys-Arg-Gln-GlnNH2 (o GIGAVLKVLTTGLPALISWIKRKRQQNH2)
• Glucagone (29 residui): fattore iperglicemico, usato come anti-diabete; ha sequenza aminoacidica: His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp~
~Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (o HSQGTFTSDYSKYLDSRRAQDFVQWLMNT)
• Insulina (51 residui): ormone pancreatico, usato nel trattamento dei diabeti
• Melittina (26 residui): veleno dell'ape domestica, usata per il trattamento dei reumatismi; ha sequenza aminoacidica: Gly-Ile-Gly-Ala-Val-Leu-Lys-Val-Leu-Thr-Thr-Gly-Leu-Pro~
~Ala-Leu-Ile-Ser-Trp-Ile-Lys-Arg-Lys-Arg-Gln-GlnNH2 (o GIGAVLKVLTTGLPALISWIKRKRQQNH2)
• Glucagone (29 residui): fattore iperglicemico, usato come anti-diabete; ha sequenza aminoacidica: His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp~
~Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr (o HSQGTFTSDYSKYLDSRRAQDFVQWLMNT)
• Insulina (51 residui): ormone pancreatico, usato nel trattamento dei diabeti
 I diversi aminoacidi che formano un peptide o una proteina, e l'ordine in cui sono uniti assieme tramite legami peptidici è definito struttura primaria. Dagli esempi mostrati sopra, dovrebbe essere evidente che non compito banale determinare la struttura primaria di tali composti, anche di quelli di modeste dimensioni.
L'idrolisi completa di una proteina o di un peptide, seguita da analisi degli aminoacidi stabilisce la sua composizione grezza, ma non fornisce alcuna informazione circa la sequenza dei legami.
L'idrolisi parziale produrrà una miscela di peptidi più corti e di alcuni aminoacidi. Se le strutture primarie di questi frammenti sono note, è qualche volta possibile dedurre parte o tutta la struttura originale traendo vantaggio dai pezzi che si sovrappongono. Per esempio, se un eptapeptide era composto da tre glicine, due alanine, una leucina ed una valina, potrebbero essere scritte molte strutture primarie possibili. D'altra parte, se l'idrolisi parziale aveva portato a due frammenti di un tripeptide noto e a due frammenti di un dipeptide noto, come mostrato sotto, la semplice analisi delle unità che si sovrappongono identifica la struttura primaria originale.
I diversi aminoacidi che formano un peptide o una proteina, e l'ordine in cui sono uniti assieme tramite legami peptidici è definito struttura primaria. Dagli esempi mostrati sopra, dovrebbe essere evidente che non compito banale determinare la struttura primaria di tali composti, anche di quelli di modeste dimensioni.
L'idrolisi completa di una proteina o di un peptide, seguita da analisi degli aminoacidi stabilisce la sua composizione grezza, ma non fornisce alcuna informazione circa la sequenza dei legami.
L'idrolisi parziale produrrà una miscela di peptidi più corti e di alcuni aminoacidi. Se le strutture primarie di questi frammenti sono note, è qualche volta possibile dedurre parte o tutta la struttura originale traendo vantaggio dai pezzi che si sovrappongono. Per esempio, se un eptapeptide era composto da tre glicine, due alanine, una leucina ed una valina, potrebbero essere scritte molte strutture primarie possibili. D'altra parte, se l'idrolisi parziale aveva portato a due frammenti di un tripeptide noto e a due frammenti di un dipeptide noto, come mostrato sotto, la semplice analisi delle unità che si sovrappongono identifica la struttura primaria originale.
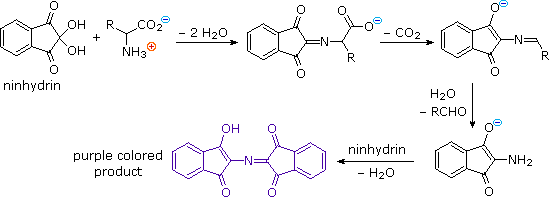
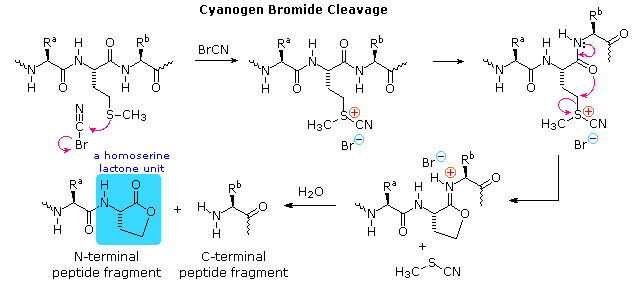
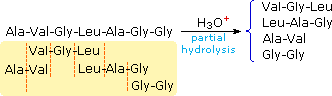 Ovviamente, questo genere di determinazione della struttura è molto inefficiente ed inaffidabile. Primo, necessitiamo di sapere le strutture di tutti i frammenti che si sovrappongono. Secondo, i peptidi più grandi dovrebbero dare miscele complesse che dovrebbero essere separate ed esaminate meticolosamente per trovare pezzi adatti per la sovrapposizione. Dovrebbe essere notato, comunque, la moderna spettrometria di massa usa questa tecnica di sovrapossizione efficacemente. La differenza è che la scissione dei legami non è ottenuta tramite idrolisi, ed i computers velocizzano il processo comparando innumerevoli frammenti.
Ovviamente, questo genere di determinazione della struttura è molto inefficiente ed inaffidabile. Primo, necessitiamo di sapere le strutture di tutti i frammenti che si sovrappongono. Secondo, i peptidi più grandi dovrebbero dare miscele complesse che dovrebbero essere separate ed esaminate meticolosamente per trovare pezzi adatti per la sovrapposizione. Dovrebbe essere notato, comunque, la moderna spettrometria di massa usa questa tecnica di sovrapossizione efficacemente. La differenza è che la scissione dei legami non è ottenuta tramite idrolisi, ed i computers velocizzano il processo comparando innumerevoli frammenti.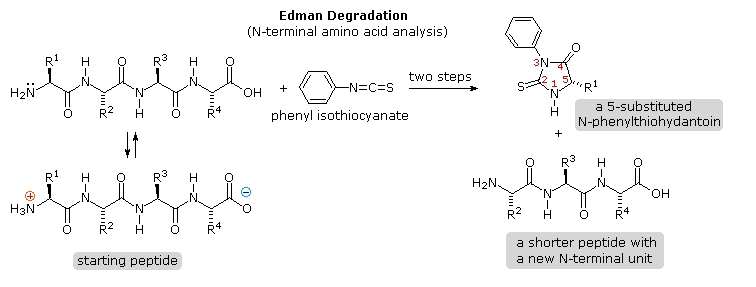 Il reagente fenile isotiocianato attacca e rimuove l'unità aminoacidica N-terminale nella forma di un eterociclo tioidantoina sostituito. I derivati caratteristici di questo tipo di tutti gli aminoacidi sono stati fatti e catalogati, così l'identificazione dell'unità terminale è portata a termine facilmente per paragone.
Il reagente fenile isotiocianato attacca e rimuove l'unità aminoacidica N-terminale nella forma di un eterociclo tioidantoina sostituito. I derivati caratteristici di questo tipo di tutti gli aminoacidi sono stati fatti e catalogati, così l'identificazione dell'unità terminale è portata a termine facilmente per paragone.
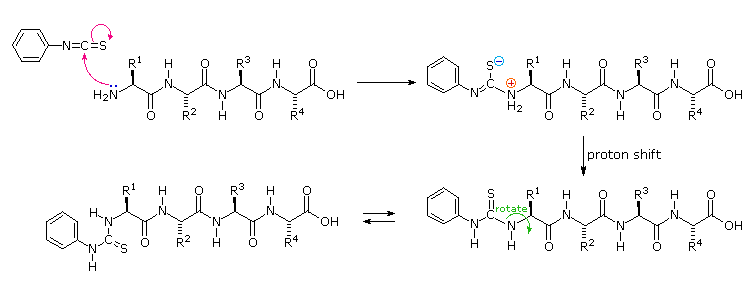 Il gruppo amino terminale si addizione alla funzione reattiva isotiocianato a dare una tiourea sostituita. Questa metà è conformazionalmente mobile, e l'atomo di zolfo può avvicinarsi alla carbonile del carbossile di un aminoacido N-terminale.
Il gruppo amino terminale si addizione alla funzione reattiva isotiocianato a dare una tiourea sostituita. Questa metà è conformazionalmente mobile, e l'atomo di zolfo può avvicinarsi alla carbonile del carbossile di un aminoacido N-terminale.
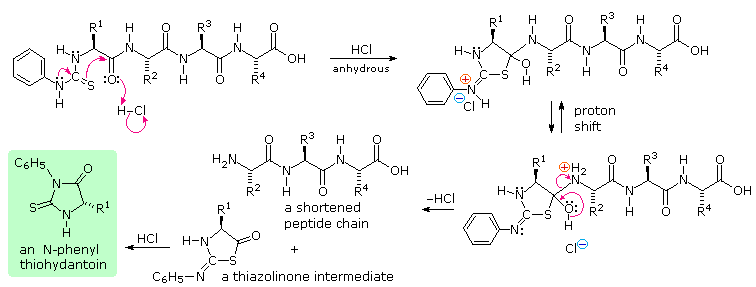 HCl anidro protona l'atomo di ossigeno dell'ammide, attivandolo verso l'attacco nucleofilo tramite zolfo. Poi, un eterociclo tiazolinone che incorpora l'unità N-terminale viene scisso, lasciando indietro una catena peptidica più corta. Questo anello eterociclico è instabile e subisce riarrangiamento acido catalizzato a tioidantoina isomerica (nel riquadro verde ombreggiato).
Una vantaggio maggiore della procedura di Edman è che la catena peptidica rimanente non è ulteriormente degradata durante la reazione. Questo significa che l'analisi N-terminale può essere ripetuta diverse volte, fornendo quindi la sequenza dei primi tre-cinque aminoacidi nella catena. Uno svantaggio della procedura è che peptidi più grandi di 30-40 unità non danno risultati soddisfacenti.
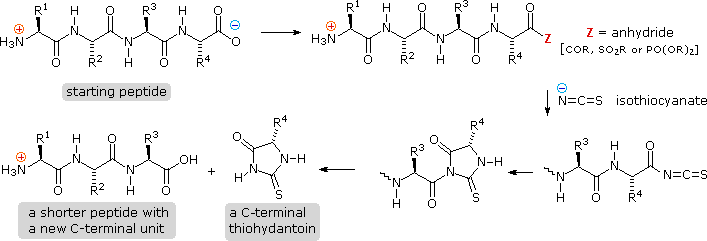
4. Analisi del gruppo C-terminale
• Chimica
L'analisi complementare C-terminale delle catene peptidiche può essere portata a termine chimicamente o enzimaticamente. L'analisi chimica è leggermente più complessa della procedura di Edman. Prima, i gruppi carbossilici in catena laterale e i gruppi idrossilici devono essere protetti come ammidi o esteri. Poi, il gruppo carbossile C-terminale viene attivato come anidride e fatto reagire con tiocianato. L'acile tiocianato risultante immediatamente ciclizza ad idantoina, e questa può essere scissa dalla catena peptidica in diversi modi, non descritti qui. A seconda della natura di questa scissione finale, la procedura può essere modificata per dare come prodotto un peptide acile tiocianato C-terminale che automaticamente riarrangia ad un tioidantoina che incorpora la penultima unità C-terminale. Quindi, analisi ripetute possono essere condotte in un modo molto simile a quello usato per la procedura di Edman.
HCl anidro protona l'atomo di ossigeno dell'ammide, attivandolo verso l'attacco nucleofilo tramite zolfo. Poi, un eterociclo tiazolinone che incorpora l'unità N-terminale viene scisso, lasciando indietro una catena peptidica più corta. Questo anello eterociclico è instabile e subisce riarrangiamento acido catalizzato a tioidantoina isomerica (nel riquadro verde ombreggiato).
Una vantaggio maggiore della procedura di Edman è che la catena peptidica rimanente non è ulteriormente degradata durante la reazione. Questo significa che l'analisi N-terminale può essere ripetuta diverse volte, fornendo quindi la sequenza dei primi tre-cinque aminoacidi nella catena. Uno svantaggio della procedura è che peptidi più grandi di 30-40 unità non danno risultati soddisfacenti.
4. Analisi del gruppo C-terminale
• Chimica
L'analisi complementare C-terminale delle catene peptidiche può essere portata a termine chimicamente o enzimaticamente. L'analisi chimica è leggermente più complessa della procedura di Edman. Prima, i gruppi carbossilici in catena laterale e i gruppi idrossilici devono essere protetti come ammidi o esteri. Poi, il gruppo carbossile C-terminale viene attivato come anidride e fatto reagire con tiocianato. L'acile tiocianato risultante immediatamente ciclizza ad idantoina, e questa può essere scissa dalla catena peptidica in diversi modi, non descritti qui. A seconda della natura di questa scissione finale, la procedura può essere modificata per dare come prodotto un peptide acile tiocianato C-terminale che automaticamente riarrangia ad un tioidantoina che incorpora la penultima unità C-terminale. Quindi, analisi ripetute possono essere condotte in un modo molto simile a quello usato per la procedura di Edman.
 • Enzimatica
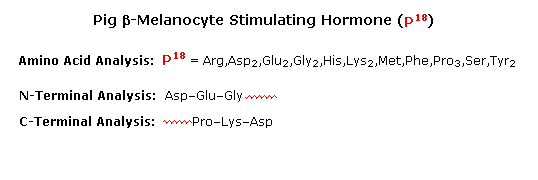
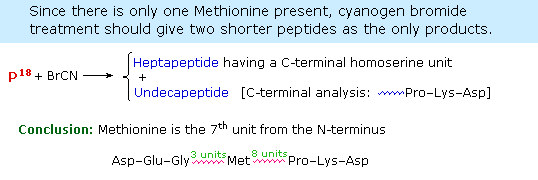
La scissione enzimatica dell'aminoacido C-terminale tramite uno dei diversi enzimi carbossipeptidasi è un metodo di analisi veloce e conveniente. Poiché il peptide prodotto accorciato è anche soggetto alla scissione enzimatica, deve essere fatta molta attenzione per controllare le condizioni di reazione così che i prodotti delle scissioni successive siano correttamente monitate. Il seguente esempio illustra questa caratteristica. Un peptide avente una sequenza C-terminale: ~Gly-Ser-Leu è soggetto alla scissione tramite carbossipeptidasi, e gli aminoacidi liberati in questa reazione sono analizzati ad intervalli di tempo crescenti. Sotto sono mostrati i risultati di questo esperimento. La leucina è scissa per prima, la serina per seconda, e la glicina per terza, come dimostrato dalla analisi sequenziale. ovviamente, la quarta e le quintà unità saranno anche esse rilasciate al passare del tempo, ma questi prodotti non sono mostrati.
• Enzimatica
La scissione enzimatica dell'aminoacido C-terminale tramite uno dei diversi enzimi carbossipeptidasi è un metodo di analisi veloce e conveniente. Poiché il peptide prodotto accorciato è anche soggetto alla scissione enzimatica, deve essere fatta molta attenzione per controllare le condizioni di reazione così che i prodotti delle scissioni successive siano correttamente monitate. Il seguente esempio illustra questa caratteristica. Un peptide avente una sequenza C-terminale: ~Gly-Ser-Leu è soggetto alla scissione tramite carbossipeptidasi, e gli aminoacidi liberati in questa reazione sono analizzati ad intervalli di tempo crescenti. Sotto sono mostrati i risultati di questo esperimento. La leucina è scissa per prima, la serina per seconda, e la glicina per terza, come dimostrato dalla analisi sequenziale. ovviamente, la quarta e le quintà unità saranno anche esse rilasciate al passare del tempo, ma questi prodotti non sono mostrati.





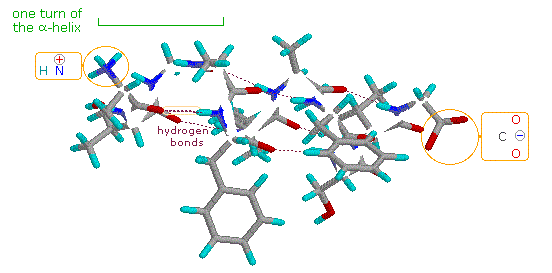



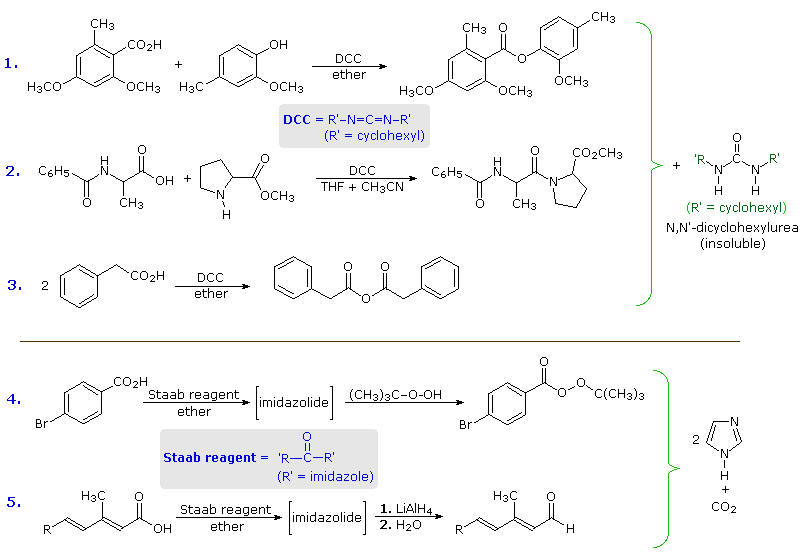 I meccanismi tramite cui questi reagenti attivano gli acidi carbossilici sono mostrati sotto. Tenete in mente che l'imidazolo è un acido più forte dell'acqua ed un gruppo uscente migliore dell'anione idrossido, specialmente se protonato.
I meccanismi tramite cui questi reagenti attivano gli acidi carbossilici sono mostrati sotto. Tenete in mente che l'imidazolo è un acido più forte dell'acqua ed un gruppo uscente migliore dell'anione idrossido, specialmente se protonato.
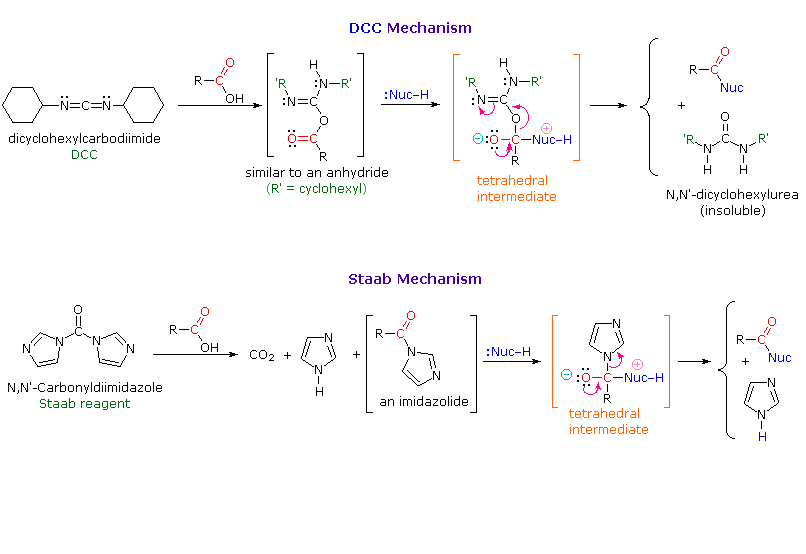 La sua applicazione alla sintesi peptidica diventerà chiara nella discussione che segue.
La strategia per la sintesi peptidica, come sottolineato qui, dovrebbe ora essere chiara. Il seguente esempio mostra una sintesi selettiva del dipeptide Ala-Gly.
La sua applicazione alla sintesi peptidica diventerà chiara nella discussione che segue.
La strategia per la sintesi peptidica, come sottolineato qui, dovrebbe ora essere chiara. Il seguente esempio mostra una sintesi selettiva del dipeptide Ala-Gly.
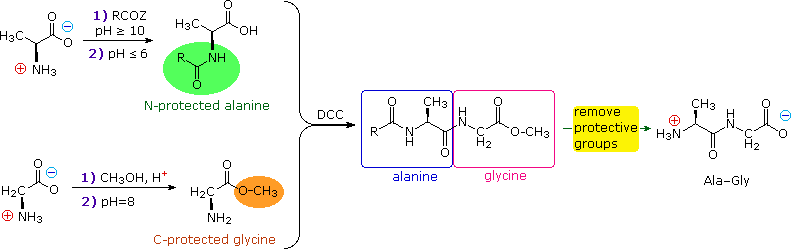 Un compito importante rimane da affrontare. Dato che il gruppo N-protettivo è una ammide, la rimozione di questa funzione potrebbe richiedere condizioni che potrebbero scindere anche l'appena formato legame peptidico. Inoltre, le condizioni violente spesso richieste per l'idrolisi dell'ammide potrebbero causare considerevole racemizzazione degli aminoacidi nel peptide risultante. Questo problema colpisce al cuore della nostra strategia, così è importante fare attenzione durante la progettazione di gruppi N-protettivi specifici. In particolare, tre qualità sono volute:
1) L'ammide protetta dovrebbe essere facile da attaccare dagli aminoacidi.
2) Il gruppo amino protetto non dovrebbe reagire nelle condizioni di formazione del peptide.
3) Il gruppo ammidico protetto dovrebbe essere facile da rimuovere in condizioni blande.
Un numero di gruppi protettivi che soddisfano queste condizioni è stato ideato; e due dei più diffusamente usati gruppi protettivi, carbobenzossi (Cbz) e t-butossicarbonil (BOC o t-BOC), sono descritti qui.
Un compito importante rimane da affrontare. Dato che il gruppo N-protettivo è una ammide, la rimozione di questa funzione potrebbe richiedere condizioni che potrebbero scindere anche l'appena formato legame peptidico. Inoltre, le condizioni violente spesso richieste per l'idrolisi dell'ammide potrebbero causare considerevole racemizzazione degli aminoacidi nel peptide risultante. Questo problema colpisce al cuore della nostra strategia, così è importante fare attenzione durante la progettazione di gruppi N-protettivi specifici. In particolare, tre qualità sono volute:
1) L'ammide protetta dovrebbe essere facile da attaccare dagli aminoacidi.
2) Il gruppo amino protetto non dovrebbe reagire nelle condizioni di formazione del peptide.
3) Il gruppo ammidico protetto dovrebbe essere facile da rimuovere in condizioni blande.
Un numero di gruppi protettivi che soddisfano queste condizioni è stato ideato; e due dei più diffusamente usati gruppi protettivi, carbobenzossi (Cbz) e t-butossicarbonil (BOC o t-BOC), sono descritti qui.
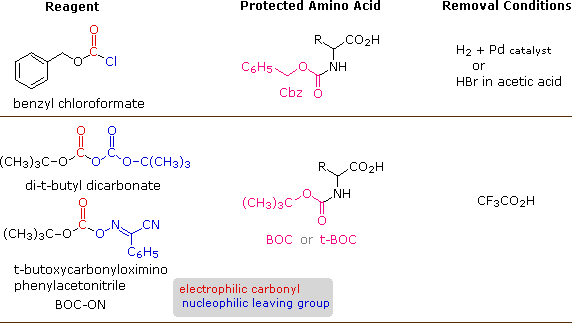 I reagenti per l'introduzione di questi gruppi N-protettivi sono i cloruri acilici o le anidridi mostrate nella porzione sinistra dello schema sopra. La reazione con una funzione aminica libera di un aminoacidi avviente rapidamente a dare il derivato aminoacidico "protetto" mostrato al centro. Questo può quindi essere usato per formare il legame peptidico (ammidico) con un secondo aminoacido. Una volta creato il legame peptidico desiderato, il gruppo protettivo può essere rimosso in condizioni relativamente blande, non idrolitiche.
I reagenti per l'introduzione di questi gruppi N-protettivi sono i cloruri acilici o le anidridi mostrate nella porzione sinistra dello schema sopra. La reazione con una funzione aminica libera di un aminoacidi avviente rapidamente a dare il derivato aminoacidico "protetto" mostrato al centro. Questo può quindi essere usato per formare il legame peptidico (ammidico) con un secondo aminoacido. Una volta creato il legame peptidico desiderato, il gruppo protettivo può essere rimosso in condizioni relativamente blande, non idrolitiche.
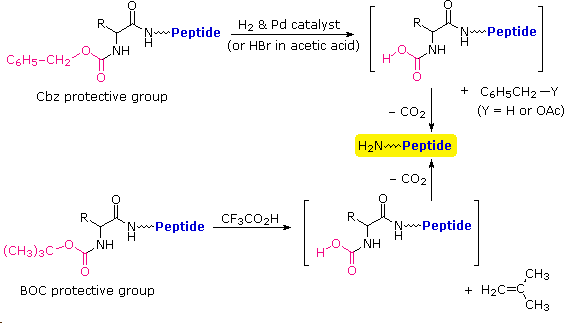 Le equazioni che mostrano la rimozione del gruppo protettivo sono mostrate sopra. La scissione dei gruppi reattivi benzile o t-butile generat un comune intermedio acido carbammico (HOCO-NHR) che perde spontaneamente CO2, dando l'amina corrispondente. Se il metil estere all'estremità C-terminale è lasciato in loco, questa sequenza di reazioni può essere ripetuta, usando un differente aminoacido N-protetto come agente acilante. La rimozione dei gruppi protettivi dovrebbe quindi portare ad un tripeptide specifico, determinato dalla natura dei reagenti e dall'ordine delle reazioni.
Le equazioni che mostrano la rimozione del gruppo protettivo sono mostrate sopra. La scissione dei gruppi reattivi benzile o t-butile generat un comune intermedio acido carbammico (HOCO-NHR) che perde spontaneamente CO2, dando l'amina corrispondente. Se il metil estere all'estremità C-terminale è lasciato in loco, questa sequenza di reazioni può essere ripetuta, usando un differente aminoacido N-protetto come agente acilante. La rimozione dei gruppi protettivi dovrebbe quindi portare ad un tripeptide specifico, determinato dalla natura dei reagenti e dall'ordine delle reazioni.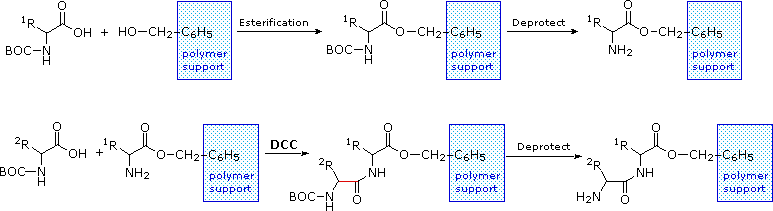
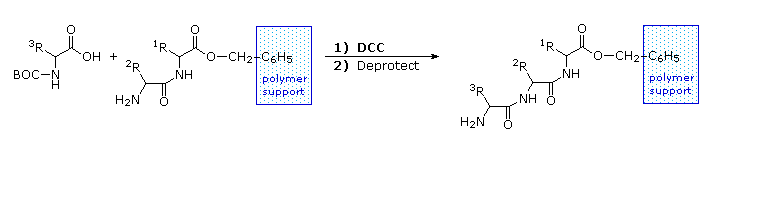
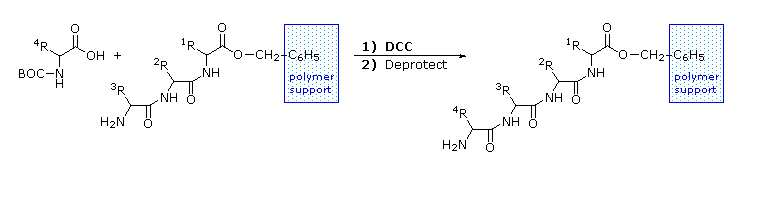
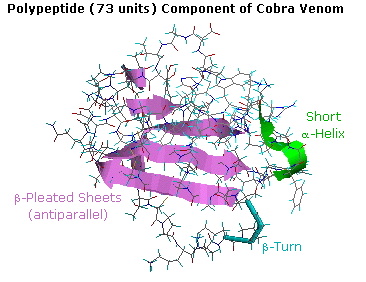
 La ribonucleasi A è notevolmente stabile. Una procedura per purificarla comporta il trattamento con una soluzione calda di acido solforico, che denatura e parzialmente decompone la maggior parte delle proteine rispetto alla ribonucleasi A. Questa stabilità riflette il fatto che questo enzima funziona nell'ambiente inospitale del tratto digerente. La ribonucleasi A fu il primo enzima sintetizzato da R. Bruce Merrifield, dimonstrando che le molecole biologiche sono semplicemente entità chimiche che possono essere costruite artificialmente.
La ribonucleasi A è notevolmente stabile. Una procedura per purificarla comporta il trattamento con una soluzione calda di acido solforico, che denatura e parzialmente decompone la maggior parte delle proteine rispetto alla ribonucleasi A. Questa stabilità riflette il fatto che questo enzima funziona nell'ambiente inospitale del tratto digerente. La ribonucleasi A fu il primo enzima sintetizzato da R. Bruce Merrifield, dimonstrando che le molecole biologiche sono semplicemente entità chimiche che possono essere costruite artificialmente.