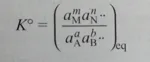anto007
2021-08-28 14:33
Ciao a tutti 
ho il seguente esercizio: "Si conoscono le energie libere molari di formazione a 25°C di IBr (3,7 kJ mol^-1) e di ICl (-5,5 kJ mol^-1). Dedurre:
a) l'energia libera standard delle reazioni (1) e (2) a 25°C;
b) se IBr e ICl sono stabili a 25°C quando tutte le sostanze sono nei loro sti standard;
c) le costanti di equilibrio a 25°C delle reazioni.
2IBr (g)---->I2 (g) + Br2 (l) (1)
2ICl (g) ----> I2 (g) + Cl2 (g) (2)"
I punti a) e b) li ho risolti
a) ΔG°r= ƩΔG°(f)(prodotti)-ƩΔG°(f)(reagenti)
ΔG°r1=0-(2*3,7 kJ mol^-1)= -7,4 kJ mol^-1
ΔG°r2= 0-(-25,5 kJ mol^-1) = 11,0 kJ mol^-1
b) ΔG°r1=-7,4 kJ mol^-1<0, IBr è instabile a 25°C
c) per il calcolo della costante di equilibrio K° ho la seguente formula: (vedi foto allegata)
Ma non so come applicarla  , un aiuto???
, un aiuto???
Grazie mille