quimico
2012-02-27 20:30
Pochissimi campi della chimica hanno mostrato un tale considerevole interesse come la chimica organofluoro. Il fluoro è forse l'elemento che ha sperimentao il più grande, recente, interesse come evidenziato dall'eccezionalmente elevato numero di pubblicazioni e dall'elevata percentuale di nuovo molecole fluorurate durante i decenni recenti. Oggi, la significativa espansione nell'uso di composti chimici fluorurati ha attratto l'attenzione dei chimici organici, agrochimici, chimici medici, e chimici dei materiali. La sostituzione dell'idrogeno da parte del fluoro, l'elemento più elettronegativo, altera stericamente ed elettronicamente le proprietà delle molecole, incidendo sulla basicità o acidità dei gruppi vicinali, sul momento dipolare, e sulla reattività e stabilità globale. Il fluoro è spesso considerato come uno isostere dell'idrogeno nonostante il fatto che i loro raggi di van der Waals siano diversi (1.47 versus 1.20 Å). La lunghezza del legame carbonio-fluoro (1.39 Å) è simile a quella del legame carbonio-ossigeno (1.43 Å), suggerendo un comportamento isosterico. L'elevata energia del legame carbonio-fluoro (485.7 kJ/mol) conferisce una stabilità relativa nei confronti delle trasformazioni metaboliche. In aggiunta, il fluoro può partecipare nelle interazioni legame ad idrogeno con i legami H-C anche se i legami ad idrogeno verso il legame C-F siano certamente più deboli di quelli osservati nel caso dell'ossigeno o dell'azoto. Nonostante ciò, rimane la controversia sull'esistenza di legami ad idrogeno tra il gruppo C-F ed i donatori -OH o -NH. Per quanto riguarda il gruppo CF3, la sua dimensione (volume di van der Waals) è relativamente grande, tra quelle dei gruppi iPr e tBu. Il gruppo CF3 ha un'elettronegatività simile a quella dell'ossigeno e un grande parametro idrofobico. Il gruppo trifluorometile si riscontra in molti composti farmaceutici e agrochimici biologicamente attivi. L'aumentata lipofilicità ed una superiore stabilità metabolica, comparata a quella degli analoghi trimetile, spesso spiegano il profilo di attività migliorato. I gruppi fluoroalchile superiori, che sono i gruppo perfluoroalchile, sono introdotti principalmente per aumentare la lipofilicità, ed anche nel contesto della chimica del fluoro. I composti organici parzialmente fluorurati sono preparati tramite due diversi approcci: (i) tramite inserzione di un gruppo che già contiene legami C-F in una molecola esistente (the building-block approach), o (ii) tramite creazioni di nuovi legami C-F attraverso la fluorurazione.

 ).
). 
 Il fluoro elementale e molti altri agenti fluoruranti elettrofili sono stati ampiamente usati in sintesi; comunque, la maggior parte di questi sono estremamente aggressivi, instabili, e richiedono speciale equipaggiamento ed attenzione per esser maneggiati in sicurezza.
Per contrasto, lo iodotoluene difluoruro (tol-IF2) è semplice da maneggiare, ed è meno tossico di molti altri agenti fluoruranti.
È stata riportata recentemente una nuova metodologia per la sintesi di eteri ciclici fluorurati, che utilizza tol-IF2 per ottenere una espansione d'anello assieme a fluorurazione di anelli a quattro, cinque, e sei membri.
La monofluorurazione selettiva di β-chetoesteri, β-chetoammidi, e β-dichetoni avviene senza bisogno di complessi HF-amina in condizioni blande. La formazione dei difluoro derivati non è stata riscontrata in queste reazioni.
SALI DI N-FLUOROPIRIDINIO
I sali di N-fluoropiridinio sono particolarmente utili come agenti fluoruranti elettrofili nei confronti dei composti organici in termini di facilità di maneggiamento e variabilità del potere e della selettività di fluorurazione. Questa variabilità rende selettiva la fluorurazione di un ampio range di composti organici che differiscono nella reattività.
Tre classi di agenti fluoruranti a potere e selettività variabile sono stati sviluppati e utilizzati con successo per le fluorurazioni selettive di diversi substrati: serie di sali di N-fluoropiridinio non legati ad un controione,
serie di sali di N-fluoropiridinio legati ad un controione solfonato, e serie di sali dimerici di N,N'-difluorobipiridinio.
L'N-fluoropiridinio trifluorometanesolfonato (triflato) ed i suoi analoghi sono agenti fluoruranti largamente applicabili, stabili con gradi di potere e selettività variabili nelle fluorurazioni.
I reagenti sono tutti stabili, cristallini e quindi possono essere maneggiati senza alcun problema nella quotidianità. Andrebbe notato che la stabilità relativa dei sali di N-fluropiridinio diminuisce con l'aumentare del potere fluorurante.
Il fluoro elementale e molti altri agenti fluoruranti elettrofili sono stati ampiamente usati in sintesi; comunque, la maggior parte di questi sono estremamente aggressivi, instabili, e richiedono speciale equipaggiamento ed attenzione per esser maneggiati in sicurezza.
Per contrasto, lo iodotoluene difluoruro (tol-IF2) è semplice da maneggiare, ed è meno tossico di molti altri agenti fluoruranti.
È stata riportata recentemente una nuova metodologia per la sintesi di eteri ciclici fluorurati, che utilizza tol-IF2 per ottenere una espansione d'anello assieme a fluorurazione di anelli a quattro, cinque, e sei membri.
La monofluorurazione selettiva di β-chetoesteri, β-chetoammidi, e β-dichetoni avviene senza bisogno di complessi HF-amina in condizioni blande. La formazione dei difluoro derivati non è stata riscontrata in queste reazioni.
SALI DI N-FLUOROPIRIDINIO
I sali di N-fluoropiridinio sono particolarmente utili come agenti fluoruranti elettrofili nei confronti dei composti organici in termini di facilità di maneggiamento e variabilità del potere e della selettività di fluorurazione. Questa variabilità rende selettiva la fluorurazione di un ampio range di composti organici che differiscono nella reattività.
Tre classi di agenti fluoruranti a potere e selettività variabile sono stati sviluppati e utilizzati con successo per le fluorurazioni selettive di diversi substrati: serie di sali di N-fluoropiridinio non legati ad un controione,
serie di sali di N-fluoropiridinio legati ad un controione solfonato, e serie di sali dimerici di N,N'-difluorobipiridinio.
L'N-fluoropiridinio trifluorometanesolfonato (triflato) ed i suoi analoghi sono agenti fluoruranti largamente applicabili, stabili con gradi di potere e selettività variabili nelle fluorurazioni.
I reagenti sono tutti stabili, cristallini e quindi possono essere maneggiati senza alcun problema nella quotidianità. Andrebbe notato che la stabilità relativa dei sali di N-fluropiridinio diminuisce con l'aumentare del potere fluorurante.
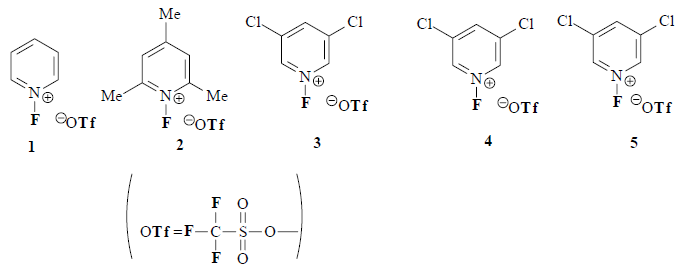 Il reagente più debole, 2, è il più adatto per fluorurare composti reattivi o facilmente ossidati, come carbanioni, enamine, e solfuri, mentre i reagenti più potenti 4 e 5 vengono preferiti per la fluorurazione di alcheni ed anelli aromatici.
L'N-fluoropiridinio triflato mostra un'elevata regioselettività nelle sue fluorurazioni. Con gli steroidi, in presenza di due siti reattivi, 1 reagisce a dare esclusivamente il monofluoro derivato. Quindi 1 può distinguere ad esempio tra un vinile acetato coniugato ed uno non coniugato, e tra un enol silil etere ed un vinile acetato nelle sue fluorurazioni. Anche in presenza di un anello aromatico attivato è possibile fare fluorurazioni selettive.
SCAMBIO DI ALOGENO, una fluorurazione selettiva alifatica in condizioni blande
Lo scambio fluoro-cloro è la tecnologia più diffusamente usata per sintetizzare molecole fluorurate. Quando questa reazione di scambio avviene in una molecola alifatica o in posizione benzilica, l'idrogeno fluoruro è il reagente industriale più versatile. La limitazione di questa tecnologia deriva dall'acidità dell'HF anidro. Il suo uso su molecole fragili o funzionalizzate è limitato a causa della formazione di intermedi cationici e di reazioni secondarie indesiderate. Alternative a ciò o versioni migliorate sono in fase di sviluppo da parte di industrie con esperienza nella chimica del fluoro.
Il primo reagente fluorurante piridinio poli(HF), o reagente di Olah, fu scoperto dal Premio Nobel George A. Olah verso la fine degli anni 70. Da allora, molte altre strutture basate sull'azoto sono emerse; con la forma generale R2N−F o R3N+−F, essi sono spesso chiamati i reagenti N-F o [N-F]+, rispettivamente.
Le Daikin Industries offrono diversi composti di piridinio derivatizzati sia per uso in laboratorio che per l'industria, incluso l'N,N′-difluoro-2,2′-bipiridinio bis(tetrafluoroborato). La DuPont rese l'N,N-dimetil-
1,1,2,2-tetrafluoroetilamina (TFEDMA) disponibile su piccola scala (laboratorio). La Mitsui Chemicals, che fa materali fluorurati per applicazioni elettroniche, vende anche la 2,2,-difluoro-1,3-dimetilimidazolidina (DFI), che scambia i gruppi idrossile e carbonile con il fluoro, quale alternativa a minor prezzo e maggiore stabilità rispetto al DAST.
In un articolo pubblicato nel 2006, Laurent Saint-Jalmes riportò nuovi reagenti fluoruranti basati su HF-base, in particolare (HF)10-piridina o (HF)3-trietilamina che permettono lo scambio alifatico cloro–fluoro su molecole sensibili agli acidi senza reazioni collaterali che coinvolgono intermedi carbocationici. A seconda della natura (piridina o trietilamina), della stechiometria della base e della temperatura, possono essere ottenuti scambi selettivi mono-, di-, o tri-cloro–
fluoro su gruppi triclorometile in alfa ad atomi di zolfo, ossigeno e carbonio.
Il triclorometilbenzil solfuro è totalmente fluorurato a 20 °C in 18 h in (HF)10-piridina (40 mol equiv di HF) e fornisce il
trifluorometilbenzil solfuro con selettività del 94% (analisi tramite 19F) e con una resa del 85% (dopo isolamento del prodotto). Sorprendentemente l'(HF)3-trietilamina (50 mol equiv di HF) porta alla fluorurazione selettiva sul triclorometilbenzil solfuro attraverso lo scambio di uno o due atomi di cloro a seconda della temperatura; a 20 °C in 4 h si ottiene il monofluorodiclorobenzil solfuro con una selettività del 90%, a 50 °C in 10 h si ottiene il difluoroclorobenzil solfuro con una selettività dell'88%. Questi risultati sono in accordo con la minore acidità dell'(HF)3-trietilamina comparata a quella dell'(HF)10-piridina; meno acido è il mezzo di fluorurazione minore è il rapporto di scambio cloro-fluoro.
Recentemente, il professor Stephen G. DiMagno alla University of Nebraska, Lincoln, USA, ha utilizzato il tetrabutilammonio fluoruro (TBAF) per reazioni Halex e di fluorodenitrazione. Il suo gruppo ha trovato che il
TBAFan in DMSO lavora bene in condizioni blande come reagente fluorurante per sistemi aromatici attivati. I risultati suggeriscono che l'accoppiamento ionico e la solvatazione sono i fattori che limitano la straordinaria nucleofilicità dello ione fluoruro nelle condizioni tipicamente impiegate per la sostituzione nucleofila aromatica.
Nel 2005, Satoshi Takei del Daiichi Pharmaceutical Company, Research Center, presentò all'ACS Meeting, a San Diego, California, un'interessante fluorurazione con il TBAF come reagente fluorurante nella sintesi del DC-756, un nuovo potente agente antibatterico chinolonico.
Il reagente più debole, 2, è il più adatto per fluorurare composti reattivi o facilmente ossidati, come carbanioni, enamine, e solfuri, mentre i reagenti più potenti 4 e 5 vengono preferiti per la fluorurazione di alcheni ed anelli aromatici.
L'N-fluoropiridinio triflato mostra un'elevata regioselettività nelle sue fluorurazioni. Con gli steroidi, in presenza di due siti reattivi, 1 reagisce a dare esclusivamente il monofluoro derivato. Quindi 1 può distinguere ad esempio tra un vinile acetato coniugato ed uno non coniugato, e tra un enol silil etere ed un vinile acetato nelle sue fluorurazioni. Anche in presenza di un anello aromatico attivato è possibile fare fluorurazioni selettive.
SCAMBIO DI ALOGENO, una fluorurazione selettiva alifatica in condizioni blande
Lo scambio fluoro-cloro è la tecnologia più diffusamente usata per sintetizzare molecole fluorurate. Quando questa reazione di scambio avviene in una molecola alifatica o in posizione benzilica, l'idrogeno fluoruro è il reagente industriale più versatile. La limitazione di questa tecnologia deriva dall'acidità dell'HF anidro. Il suo uso su molecole fragili o funzionalizzate è limitato a causa della formazione di intermedi cationici e di reazioni secondarie indesiderate. Alternative a ciò o versioni migliorate sono in fase di sviluppo da parte di industrie con esperienza nella chimica del fluoro.
Il primo reagente fluorurante piridinio poli(HF), o reagente di Olah, fu scoperto dal Premio Nobel George A. Olah verso la fine degli anni 70. Da allora, molte altre strutture basate sull'azoto sono emerse; con la forma generale R2N−F o R3N+−F, essi sono spesso chiamati i reagenti N-F o [N-F]+, rispettivamente.
Le Daikin Industries offrono diversi composti di piridinio derivatizzati sia per uso in laboratorio che per l'industria, incluso l'N,N′-difluoro-2,2′-bipiridinio bis(tetrafluoroborato). La DuPont rese l'N,N-dimetil-
1,1,2,2-tetrafluoroetilamina (TFEDMA) disponibile su piccola scala (laboratorio). La Mitsui Chemicals, che fa materali fluorurati per applicazioni elettroniche, vende anche la 2,2,-difluoro-1,3-dimetilimidazolidina (DFI), che scambia i gruppi idrossile e carbonile con il fluoro, quale alternativa a minor prezzo e maggiore stabilità rispetto al DAST.
In un articolo pubblicato nel 2006, Laurent Saint-Jalmes riportò nuovi reagenti fluoruranti basati su HF-base, in particolare (HF)10-piridina o (HF)3-trietilamina che permettono lo scambio alifatico cloro–fluoro su molecole sensibili agli acidi senza reazioni collaterali che coinvolgono intermedi carbocationici. A seconda della natura (piridina o trietilamina), della stechiometria della base e della temperatura, possono essere ottenuti scambi selettivi mono-, di-, o tri-cloro–
fluoro su gruppi triclorometile in alfa ad atomi di zolfo, ossigeno e carbonio.
Il triclorometilbenzil solfuro è totalmente fluorurato a 20 °C in 18 h in (HF)10-piridina (40 mol equiv di HF) e fornisce il
trifluorometilbenzil solfuro con selettività del 94% (analisi tramite 19F) e con una resa del 85% (dopo isolamento del prodotto). Sorprendentemente l'(HF)3-trietilamina (50 mol equiv di HF) porta alla fluorurazione selettiva sul triclorometilbenzil solfuro attraverso lo scambio di uno o due atomi di cloro a seconda della temperatura; a 20 °C in 4 h si ottiene il monofluorodiclorobenzil solfuro con una selettività del 90%, a 50 °C in 10 h si ottiene il difluoroclorobenzil solfuro con una selettività dell'88%. Questi risultati sono in accordo con la minore acidità dell'(HF)3-trietilamina comparata a quella dell'(HF)10-piridina; meno acido è il mezzo di fluorurazione minore è il rapporto di scambio cloro-fluoro.
Recentemente, il professor Stephen G. DiMagno alla University of Nebraska, Lincoln, USA, ha utilizzato il tetrabutilammonio fluoruro (TBAF) per reazioni Halex e di fluorodenitrazione. Il suo gruppo ha trovato che il
TBAFan in DMSO lavora bene in condizioni blande come reagente fluorurante per sistemi aromatici attivati. I risultati suggeriscono che l'accoppiamento ionico e la solvatazione sono i fattori che limitano la straordinaria nucleofilicità dello ione fluoruro nelle condizioni tipicamente impiegate per la sostituzione nucleofila aromatica.
Nel 2005, Satoshi Takei del Daiichi Pharmaceutical Company, Research Center, presentò all'ACS Meeting, a San Diego, California, un'interessante fluorurazione con il TBAF come reagente fluorurante nella sintesi del DC-756, un nuovo potente agente antibatterico chinolonico.