Max Fritz
2011-08-06 12:24
La dimetilgliossima è sostanzialmente la diossima del 2,3-butandione (o diacetile).
Si presenta come una polvere bianca cristallina, poco (o per nulla) solubile in acqua, ma facilmente solubile in etanolo.
E' usata in chimica analitica come reattivo per Ni2+ e Pd2+, con i quali forma complessi insolubili e colorati di formula generale M[dmgH]2, dove M è il catione metallico e dmgH è la dimetilgliossima che ha perso un idrogeno.
Avendo a disposizione un po' di reattivo, ho deciso di fare qualche test (per ora a scopo esclusivamente dimostrativo) con cationi di metalli di transizione.
ATTENZIONE: Ricordo che la dimetilgliossima e i sali di Ni(II), Co(II) sono considerati tossici.
Reagenti:
-Dimetilgliossima
-Nichel (II) cloruro esaidrato
-Ferro (II) solfato eptaidrato
-Rame (II) solfato pentaidrato
-Cobalto (II) cloruro esaidrato
-Manganese (II) solfato monoidrato
-Ferro (III) cloruro esaidrato
-Bismuto (III) nitrato basico
-Cromo (III) nitrato nonaidrato
-Ammoniaca, soluzione concentrata
Procedura:
Innanzitutto premetto che i sali indicati sono quelli che ho utilizzato io e che ovviamente ciò che influisce è quasi esclusivamente il catione, quindi non fa sostanziale differenza utilizzare un solfato al posto di un cloruro o di un nitrato e viceversa, nè tantomeno utilizzare sali a stati di idratazione differenti da quelli indicati.
Ho inizialmente fatto una prova con i cationi bivalenti di Ni, Fe, Cu, Co e Mn. Ho preparato 5 provette con un'uguale quantità di acqua distillata (5mL circa) e in ciascuna ho sciolto una spatolina dei rispettivi sali dei metalli appena citati e nello stesso ordine in cui li ho elencati.
A parte, ho preparato una soluzione idroalcolica allo 0,5% di dimetilgliossima (0,2g in 40mL di EtOH:H2O nelle rispettive proporzioni di 3:2) e ho aggiunto 2 gocce di ammoniaca concentrata (il reattivo agisce meglio a pH lievemente basici)
Ho poi aggiunto a ciascuna provetta 5-6mL di reattivo così ottenuto. Ecco il risultato:


Come potete osservare, Ni2+ è quello che dà reazione più vistosa e precipitato più visibile. Anche per Fe2+ si osserva un precipitato marrone-rosso, motivo per cui quando si utilizza la dimetilgliossima per cercare il nichel in presenza di ferro, bisogna assicurarsi che quest'ultimo sia tutto ossidato a Fe3+.
Il rame vira al verde acido scuro, il cobalto al marrone e il manganese al giallo torbido.
Tra i principali cationi bivalenti che ho omesso ci sono quelli di Pb, Cd, Hg, Zn che mi sembravano abbastanza insignificanti soprattutto dal punto di vista dell'effetto cromatico.
In seguito ho fatto delle prove con 3 cationi trivalenti, rispettivamente Bi3+, Fe3+ e Cr3+. Ecco le loro soluzioni acquose:
E il risultato dopo l'aggiunta del reattivo:
Si osserva solo per il bismuto un precipitato bianco. Secondo il Vogel questo ione interferisce con l'analisi del nichel dando precipitato giallo, ma purtroppo non ho sperimentato la miscela dei due.
Fe(III) dà una colorazione rosso molto scuro, ma perfettamente limpida e senza precipitato, il che conferma la non-interferenza di questo ione con l'analisi del nichel, a differenza di Fe(II).
Il cromo vira al verde senza dare alcun precipitato.
Per permettere una migliore visualizzazione del colore del complesso Ni[dmgH]2 l'ho versato su della carta da filtro:
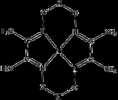
Per finire, ecco la formula del reattivo (a sinistra) e del complesso con Ni(II) (a destra):
I seguenti utenti ringraziano Max Fritz per questo messaggio: Franc, rock.angel, Dott.MorenoZolghetti, ale93, luigi_67, fosgene