TNon riesco a risolvere questo caso particolare di redox, mi dite se sto sbagliando qualcosa nel procedimento? Non riesco a proseguire!
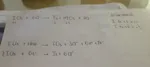 image.jpeg
image.jpeg
sciviamo le due semireazioni:
I+++ + 3H2O <==> HIO3 + 5H+ + 2e-
2I+++ + 6e- <==> I2
sommiamo dopo aver moltiplicato la prima x3 per pareggiare gli e-
5I+++ + 9H2O <==> 3HIO3 + 15H+ + I2
aggiungiamo infine da entrambe le parti i 15 Cl- mancanti
5ICl3 + 9H2O <==> 3HIO3 +15HCl + I2
saluti
Mario
I seguenti utenti ringraziano Mario per questo messaggio: Mariù
2I(3+) + 6e- --> I2
3( I(3+) + 3H2O --> IO3(-) + 2e- + 6H(+) )
____________________________________
5I(3+) + 9H2O --> I2 + 3IO3(-) + 18H(+)
5ICl3 + 9H2O --> I2 + 3HIO3 + 15HCl
I seguenti utenti ringraziano Igor per questo messaggio: Mariù
Mi sono confusa perchè ho messo anche il Cloro di mezzo, grazie a tutti!
Mario ha scritto:
sciviamo le due semireazioni:
I+++ + 3H2O <==> HIO3 + 5H+ + 2e-
2I+++ + 6e- <==> I2
sommiamo dopo aver moltiplicato la prima x3 per pareggiare gli e-
5I+++ + 9H2O <==> 3HIO3 + 15H+ + I2
aggiungiamo infine da entrambe le parti i 15 Cl- mancanti
5ICl3 + 9H2O <==> 3HIO3 +15HCl + I2
saluti
Mario
Perchè hai messo 5 H+?
Le due semireazioni di ossidazione e di riduzione vanno bene.
Subito dopo devi bilanciare il numero di elettroni moltiplicando per 3 tutta la semireazione di ossidazione:
3 x (ICl3 + 3H2O --> HIO3 + 3HCl +2H+ + 2e-)
2ICl3 + 6e- --> I2 + 6Cl-
Poi devi sommare membro a membro le due semireazioni:
5ICl3 + 9H2O --> 3HIO3 + I2 + 15HCl
Tre metodi diversi di bilanciamento di una redox 
I seguenti utenti ringraziano LuiCap per questo messaggio: Mariù