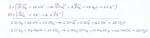Ale
2019-02-15 09:39
Salve avrei bisogno di sapere se la risoluzione dei seguenti esercizi è corretta. Allego i miei procedimenti.
-Per titolare 32.0 mL di idrossido di magnesio furono necessari 50.9 mL di acido cloridrico 0.200 mol/L. Calcolare la concentrazione in mol/L della base e il pH al punto equivalente.
-Alla temperatura di 27 °C, in un recipiente del volume di 2.00 L vengono introdotti 3.06 g di solfuro acido di ammonio (NH4HS, solido). Questo composto è instabile, a 27 °C si decompone al 30% in ammoniaca e solfuro di idrogeno (entrambi allo stato gassoso). Dopo aver scritto e bilanciato la reazione, calcolare il valore della costante di equilibrio per la reazione di decomposizione alla temperatura indicata.
-Redox: CrI3 + Cl2 +NaOH → Na2CrO4 + NaIO3 + NaCl
Grazie...