Fab996
2016-03-24 10:03
Fab996
2016-03-24 10:03
Ho svolto l'esercizio in due maniere diverse e non riesco a capire perchè in entrambe ottengo lo stesso risultato, vi posto il procedimento
LuiCap
2016-03-24 10:59
I seguenti utenti ringraziano LuiCap per questo messaggio: Fab996
Fab996
2016-03-24 12:11
Capisco, ma come faccio ad accorgermene? Perché teoricamente i n.o. sono diversi quindi sarei stato portato a fare tutte quelle semireazioni...inoltre H2S non si scioglie in acqua ( tralasciando che ho scritto male in generale la forma ionica)?
LuiCap
2016-03-24 12:35
Te ne accorgi solo se impari ad eseguire il mio metodo, cioè:
- trasformi la reazione non bilanciata dalla forma molecolare alla forma ionica senza scrivere il numero degli ioni ma solo le specie:
K+ MnO4(-) + H+ + S(2-) + SO4(2-) --> K+ + Mn(2+) + SO4(2-) + S + H2O
- cancelli adesso gli ioni spettatori:
MnO4(-) + H+ + S(2-) --> Mn(2+) + S + H2O
- verifichi quale atomo si ossida e quale si riduce... e poi tutto il resto.
I seguenti utenti ringraziano LuiCap per questo messaggio: Fab996, luigi_67
Fab996
2016-03-24 12:52
LuiCap ha scritto:
Te ne accorgi solo se impari ad eseguire il mio metodo, cioè:
- trasformi la reazione non bilanciata dalla forma molecolare alla forma ionica senza scrivere il numero degli ioni ma solo le specie:
K+ MnO4(-) + H+ + S(2-) + SO4(2-) --> K+ + Mn(2+) + SO4(2-) + S + H2O
- cancelli adesso gli ioni spettatori:
MnO4(-) + H+ + S(2-) --> Mn(2+) + S + H2O
- verifichi quale atomo si ossida e quale si riduce... e poi tutto il resto.
Ok grazie, ma non ho ben capito quali siano gli ioni spettatori, 1) ho la reazione è trovo tutti i numeri di ossidazione2) la metto in forma ionica3) elimino gli ho gli ioni spettatori4) vedo che elementi rimangono e vedo i loro n.o. dalla reazione iniziale per capire chi si ossida e chi si riduce, ma come determinino questi ioni spettatori?
LuiCap
2016-03-24 13:33
Io però non ho scritto i passaggi in questo ordine, ma:
1- trasformi la reazione non bilanciata dalla forma molecolare alla forma ionica senza scrivere il numero degli ioni ma solo le specie:
K+ MnO4(-) + H+ + S(2-) + SO4(2-) --> K+ + Mn(2+) + SO4(2-) + S + H2O
2- cancelli adesso gli ioni spettatori, che sono quelli che compaiono sia nei reagenti che nei prodotti (te li scrivo in rosso):
K+ + MnO4(-) + H+ + S(2-) +SO4(2-)--> K+ + Mn(2+) + SO4(2-) + S + H2O
3- verifichi quale atomo si ossida e quale si riduce... e poi tutto il resto.
Fab996
2016-03-24 14:14
LuiCap ha scritto:
Io però non ho scritto i passaggi in questo ordine, ma:
1- trasformi la reazione non bilanciata dalla forma molecolare alla forma ionica senza scrivere il numero degli ioni ma solo le specie:
K+ MnO4(-) + H+ + S(2-) + SO4(2-) --> K+ + Mn(2+) + SO4(2-) + S + H2O
2- cancelli adesso gli ioni spettatori, che sono quelli che compaiono sia nei reagenti che nei prodotti (te li scrivo in rosso):
K+ + MnO4(-) + H+ + S(2-) +SO4(2-)--> K+ + Mn(2+) + SO4(2-) + S + H2O
3- verifichi quale atomo si ossida e quale si riduce... e poi tutto il resto.
Ma a me in forma ionica viene:
K+ + MnO4(-)+2H+ + S(2-)+SO4(2-)--->2K+ +SO4(2-)+Mn(2+)+SO4(2-)+S+H2O
LuiCap
2016-03-24 14:38
Io non ho scritto di scrivere il numero degli ioni, ma solo il tipo degli ioni con la loro carica elettrica!!!
Sia chiaro, non ti obbligo a seguire il mio metodo, però se lo fai bene è l'unico modo per capire quali sono le specie chimiche che partecipano realmente alla redox; gli ioni spettatori sono il contorno che non si modifica.
I seguenti utenti ringraziano LuiCap per questo messaggio: Fab996
Fab996
2016-03-24 14:57
LuiCap ha scritto:
Io non ho scritto di scrivere il numero degli ioni, ma solo il tipo degli ioni con la loro carica elettrica!!!
Sia chiaro, non ti obbligo a seguire il mio metodo, però se lo fai bene è l'unico modo per capire quali sono le specie chimiche che partecipano realmente alla redox; gli ioni spettatori sono il contorno che non si modifica.
Ah okay scusa, però comunque mi verrebbe:
K+ + MnO4(-)+H+ + S(2-)+H+ +SO4(2-)-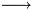 K+ +SO4(2-)+Mn(2+)+SO4(2-)+S+H2O
K+ +SO4(2-)+Mn(2+)+SO4(2-)+S+H2O
Ossia mi verrebbe un idrogeno in più ...
LuiCap
2016-03-24 16:16
Il tipo di ioni non il numero 
1 H+ a sx 0 a dx
1 SO4(2-) a sx, 1 SO4(2-) a dx
I seguenti utenti ringraziano LuiCap per questo messaggio: Fab996
Fab996
2016-03-24 16:32
LuiCap ha scritto:
Il tipo di ioni non il numero

1 H+ a sx 0 a dx
1 SO4(2-) a sx, 1 SO4(2-) a dx
Ah ok e poi semplifico quelli uguali? E dopo che li semplifico ottengo la forma ionica netta? Un'altra cosa se nella forma ionica volevo portarmi anche il numero degli ioni presenti?
LuiCap
2016-03-24 17:01
Sì, semplifichi quelli uguali e ottieni la forma ionica non bilanciata netta.
Se nella forma ionica non bilanciata ti porti dietro anche i numeri, torniamo da capo perché essa risulta:
MnO4(-) + 4H+ + S(2-) --> K+ + SO4(2-) + Mn(2+) + S + H2O
Primo, non ha molto senso perché a dx ti ritrovi del potassio che a sx non hai.
Secondo, ti si ripropone il dubbio che lo zolfo, da -2 nei reagenti, possa sia ossidarsi a S +6 che ridursi a S 0 nei prodotti.
Se invece usi il mio metodo, rimane la reale forma ionica netta:
MnO4(-) + H+ + S(2-) --> Mn(2+) + S + H2O
In questo modo tutti gli atomi degli elementi sono presenti sia nei reagenti che nei prodotti e non puoi avere alcun dubbio su quale sia l'elemento che si ossida e quello che si riduce.
I seguenti utenti ringraziano LuiCap per questo messaggio: Fab996
Fab996
2016-03-24 18:18
LuiCap ha scritto:
Sì, semplifichi quelli uguali e ottieni la forma ionica non bilanciata netta.
Se nella forma ionica non bilanciata ti porti dietro anche i numeri, torniamo da capo perché essa risulta:
MnO4(-) + 4H+ + S(2-) --> K+ + SO4(2-) + Mn(2+) + S + H2O
Primo, non ha molto senso perché a dx ti ritrovi del potassio che a sx non hai.
Secondo, ti si ripropone il dubbio che lo zolfo, da -2 nei reagenti, possa sia ossidarsi a S +6 che ridursi a S 0 nei prodotti.
Se invece usi il mio metodo, rimane la reale forma ionica netta:
MnO4(-) + H+ + S(2-) --> Mn(2+) + S + H2O
In questo modo tutti gli atomi degli elementi sono presenti sia nei reagenti che nei prodotti e non puoi avere alcun dubbio su quale sia l'elemento che si ossida e quello che si riduce.
Ho capito, ti ringrazio 


LuiCap ha scritto:
Sì, semplifichi quelli uguali e ottieni la forma ionica non bilanciata netta.
Se nella forma ionica non bilanciata ti porti dietro anche i numeri, torniamo da capo perché essa risulta:
MnO4(-) + 4H+ + S(2-) --> K+ + SO4(2-) + Mn(2+) + S + H2O
Primo, non ha molto senso perché a dx ti ritrovi del potassio che a sx non hai.
Secondo, ti si ripropone il dubbio che lo zolfo, da -2 nei reagenti, possa sia ossidarsi a S +6 che ridursi a S 0 nei prodotti.
Se invece usi il mio metodo, rimane la reale forma ionica netta:
MnO4(-) + H+ + S(2-) --> Mn(2+) + S + H2O
In questo modo tutti gli atomi degli elementi sono presenti sia nei reagenti che nei prodotti e non puoi avere alcun dubbio su quale sia l'elemento che si ossida e quello che si riduce.
Ultima cosa, io seguivo questa guida che nella forma ionica netta mette i composti col numero di quante volte sono presenti; comunque stavo leggendo un po su internet delle guide e ho trovato questa redox che ti allego che però non capisco come l'hanno svolta, secondo il metodo nella guida che ti ho postato avrei fatto(ossia portandomi tutti i numeri dietro): forma ionica Cu+H+ +NO3(-)--->Cu(2+)+2(NO3)(-)+NO+H2O; in forma ionica netta Cu+H+ --->Cu(2+)+(NO3)(-)+NO+H2O; mentre secondo il metodo tuo di portare solo il tipo verrebbe(se non sbaglio) forma ionica: Cu+H+ +NO3(-)--->Cu(2+)+NO3(-)+NO+H20; forma ionica netta: Cu+H+ --->Cu(2+)+NO+H2O; in tutti e due i casi non verrebbe come scritto nel testo...
LuiCap
2016-03-24 20:39
L'HNO3 è un acido forte e possiede anche forti proprietà ossidanti.
L'H+ svolge la sua azione come acido forte, mentre lo ione NO3(-), nel quale l'azoto ha numero do ox +5 si riduce, in ambiente acido in vari composti in cui l'azoto ha numeri di ox inferiori.
In questa redox non bilanciata in forma molecolare abbiamo:
CuNO3 + HNO3 --> Cu(NO3)2 + NO + H2O
Cu+ + NO3(-) + H+ --> Cu2+ + NO3(-) + NO + H2O
In questo caso nella reazione in forma ionica non bilanciata netta possiamo eliminare lo ione nitrato nei prodotti ma non nei reagenti, in quanto non avremmo alcun atomo di azoto nei reagenti:
Cu+ + NO3(-) + H+ --> Cu2+ + NO + H2O
che in forma ionica bilanciata diventa:
3Cu+ + NO3(-) + 4H+ --> 3Cu2+ + NO + 2H2O
Vediamo quest'altra redox:
CuCl + HNO3 --> CuCl2 + NO + H2O
Cu+ + Cl- + H+ + NO3(-) --> Cu2+ + Cl- + NO +H2O
Cu+ + H+ + NO3(-) --> Cu2+ + NO + H2O
che, bilanciata, diventa esattamente uguale alla precedente:
3Cu+ + NO3(-) + 4H+ --> 3Cu2+ + NO + 2H2O
I seguenti utenti ringraziano LuiCap per questo messaggio: Fab996
Fab996
2016-03-25 10:12
LuiCap ha scritto:
L'HNO3 è un acido forte e possiede anche forti proprietà ossidanti.
L'H+ svolge la sua azione come acido forte, mentre lo ione NO3(-), nel quale l'azoto ha numero do ox +5 si riduce, in ambiente acido in vari composti in cui l'azoto ha numeri di ox inferiori.
In questa redox non bilanciata in forma molecolare abbiamo:
CuNO3 + HNO3 --> Cu(NO3)2 + NO + H2O
Cu+ + NO3(-) + H+ --> Cu2+ + NO3(-) + NO + H2O
In questo caso nella reazione in forma ionica non bilanciata netta possiamo eliminare lo ione nitrato nei prodotti ma non nei reagenti, in quanto non avremmo alcun atomo di azoto nei reagenti:
Cu+ + NO3(-) + H+ --> Cu2+ + NO + H2O
che in forma ionica bilanciata diventa:
3Cu+ + NO3(-) + 4H+ --> 3Cu2+ + NO + 2H2O
Vediamo quest'altra redox:
CuCl + HNO3 --> CuCl2 + NO + H2O
Cu+ + Cl- + H+ + NO3(-) --> Cu2+ + Cl- + NO +H2O
Cu+ + H+ + NO3(-) --> Cu2+ + NO + H2O
che, bilanciata, diventa esattamente uguale alla precedente:
3Cu+ + NO3(-) + 4H+ --> 3Cu2+ + NO + 2H2O
Ma non capisco perchè nella prima reazione hai eliminato NO3(-) nei prodotti, teoricamente non dovresti semplificarlo con quello simile a sinistra, così come abbiano fatto ieri?
LuiCap
2016-03-25 10:55
Te l'ho spiegato, ma evidentemente non hai capito quello che ho voluto dire.
Ci riprovo in altro modo.
Una qualsiasi reazione chimica, sia redox che non redox, è bilanciata quando:
- il numero degli atomi di ciascun elemento è uguale sia nei reagenti che nei prodotti;
- il numero delle cariche reali (cioè quelle degli ioni) è uguale sia nei reagenti che nei prodotti.
Se in questa reazione non bilanciata in forma ionica:
Cu+ + NO3(-) + H+ --> Cu2+ + NO3(-) + NO + H2O
togliessi lo ione nitrato sia a sx che a dx rimarrebbe:
Cu+ + H+ --> Cu2+ + NO + H2O
e la domanda sarebbe: "Come può formarsi NO nei prodotti se fra i reagenti non c'è nemmeno un composto che contenga azoto? Impossibile, non può crearsi dal nulla, quindi lo ione nitrato fra i reagenti deve rimanere.
La ragione risiede nel fatto che, in questo caso, l'HNO3 svolge sia la funzione di acido che di ossidante.
Se leggi bene la schermata tratta dal sito Zanichelli scuola che tu stesso hai postato ieri, c'è scritto:
3. A questo punto si eliminano gli ioni spettatori, come NO3(-) presente al secondo
membro della reazione, ed eventuali specie chimiche ripetute o presenti sia tra
i reagenti che tra i prodotti, che nel nostro esempio non ce ne sono.
Cu + H+ + NO --> Cu2+ + NO3(-) + NO + H2O
I seguenti utenti ringraziano LuiCap per questo messaggio: Fab996
Fab996
2016-03-30 10:07
LuiCap ha scritto:
Te l'ho spiegato, ma evidentemente non hai capito quello che ho voluto dire.
Ci riprovo in altro modo.
Una qualsiasi reazione chimica, sia redox che non redox, è bilanciata quando:
- il numero degli atomi di ciascun elemento è uguale sia nei reagenti che nei prodotti;
- il numero delle cariche reali (cioè quelle degli ioni) è uguale sia nei reagenti che nei prodotti.
Se in questa reazione non bilanciata in forma ionica:
Cu+ + NO3(-) + H+ --> Cu2+ + NO3(-) + NO + H2O
togliessi lo ione nitrato sia a sx che a dx rimarrebbe:
Cu+ + H+ --> Cu2+ + NO + H2O
e la domanda sarebbe: "Come può formarsi NO nei prodotti se fra i reagenti non c'è nemmeno un composto che contenga azoto? Impossibile, non può crearsi dal nulla, quindi lo ione nitrato fra i reagenti deve rimanere.
La ragione risiede nel fatto che, in questo caso, l'HNO3 svolge sia la funzione di acido che di ossidante.
Se leggi bene la schermata tratta dal sito Zanichelli scuola che tu stesso hai postato ieri, c'è scritto:
3. A questo punto si eliminano gli ioni spettatori, come NO3(-) presente al secondo
membro della reazione, ed eventuali specie chimiche ripetute o presenti sia tra
i reagenti che tra i prodotti, che nel nostro esempio non ce ne sono.
Cu + H+ + NO --> Cu2+ +
NO3(-)+ NO + H2O
Capisco, ti ringrazio per la disponibilità Luisa