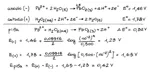Aria
2020-01-29 20:04
Disegnare il diagramma di cella e calcolare la f.e.m. della pila che sfrutta la seguente reazione a pH = 2.000: H2O2(aq) + Pb2+(aq) ® PbO2(s) + H2O(l) Considerare la concentrazione delle specie [H2O2] e [Pb2+] pari a 0.500 mol/L. (E° H2O2/ H2O = + 1.78 V ; E° Pb/Pb2+ = + 0.126 V)
L’anodo è Pb/Pb2+ e il catodo H2O2/H2O
Per il calcolo della fem della pila considero per entrambi i semielementi il potenziale di riduzione. Quindi nell’equazione di Nerst nel log il prodotto delle concentrazioni dei prodotti sul prodotto delle concentrazioni dei reagenti sarà messo in base alla reazione di riduzione della specie redox (anche se si tratta dell’anodo)?
Facendo così mi trovo Ecatodo=+1,65 V e Eanodo=-0,117 V
Fem DeltaE= +1,53V