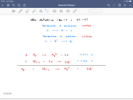
Il procedimento di risoluzione è corretto.
Facendo i calcoli senza arrotondamenti intermedi risulta:
t = 7611,671165...s = 2,11(4353101...) ore
V Cl2(g) = 7,04(4862197...) L
Il cloruro di magnesio è un composto ionico, quindi gli ioni sono già presenti allo stato solido; fornendo calore il solido fonde e gli ioni diventano più liberi di spostarsi verso gli elettrodi, dove avvengono le reazioni con scambio di elettroni.
In una cella elettrolitica il catione Mg2+ si sposta verso l'elettrodo collegato al polo negativo del generatore di corrente, il catodo, dove avviene la seguente semireazione di riduzione:
Mg2+ + 2e- --> Mg(s)............E°(catodo, polo -) = -2,372 V
L'anione Cl- si sposta invece verso l'elettrodo collegato al polo positivo del generatore di corrente, l'anodo, dove avviene la seguente semireazione di ossidazione:
2 Cl- --> Cl2(g) + 2 e-............E°(anodo, polo +) = +1,36 V
La redox che complessivamente avviene è dunque:
Mg2+ + 2 Cl- --> Mg(s) + Cl2(g)
E(cella elettrolitica) = E°(catodo) - E°(anodo) = -2,372 - 1,36 = -3,732 V
ΔG° = -nFE = -2 mol · 96485 C/mol · -3,732 J/C = 720164 J = 720 kJ
Il ΔG° positivo testimonia il fatto che la reazione non è spontanea; per farla avvenire si deve applicare al solido fuso un voltaggio superiore a 3,732 V. Nel solido fuso viene immersa una coppia di elettrodi di platino e si applica un voltaggio più positivo di 3,732 V mediante un alimentatore esterno.
1. Come faccio a vedere analiticamente che le moli di magnesio sono uguali alle moli di cloro gassoso?
Dai coefficienti stechiometrici della reazione,
La reazione non spontanea che avviene nella cella elettrolitica si legge nel seguente modo:
1 mol di ione magnesio reagisce con 2 mol di ione cloruro per dare 1 mol di magnesio solido e 1 mol di cloro gassoso.
Spontaneamente la reazione procede nel verso opposto e può essere sfruttata in una cella elettrochimica per trasformare l'energia chimica in energia elettrica; infatti il Cl2 ha un potenziale di riduzione standard maggiore (+1,36 V) rispetto allo ione Mg2+ (-2,372), quindi spontaneamente è il Cl2 che si riduce e non l'Mg2+:
Mg(s) --> Mg2+ + 2 e-............E°(anodo, polo -) = -2,372 V
Cl2(g) + 2 e- --> 2 Cl-.............E°(catodo, polo +) = +1,36 V
La redox che complessivamente avviene è dunque:
Mg(s) + Cl2(g) --> Mg2+ + 2 Cl
E(cella elettrochimica) = E°(catodo) - E°(anodo) = 1,36 - (- 2,372) = +3,732 V
ΔG° = -nFE = -2 mol · 96485 C/mol · 3,732 J/C = 720164 J = -720 kJ
Il ΔG° negativo testimonia il fatto che la reazione è spontanea; per farla avvenire occorre collegare con un filo elettrico una barretta di Mg immersa in una soluzione di Mg2+ ad un elettrodo di platino immerso in una soluzione di ioni Cl- sul quale viene insufflato Cl2 gassoso. Le due soluzioni vanno collegate con un ponte salino.
3. Come faccio a capire quando la reazione avviene spontaneamente oppure no, quindi se ci troviamo in una cella voltaica oppure in una cella elettrolitica?
Si devono confrontare fra loro due equilibri redox che si trovano nella serie dei potenziali standard di riduzione.
Esempio 1
Zn2+ + 2 e- <--> Zn(s).........E° = -0,76 V
Cu2+ + 2 e- <--> Cu(s).........E° = +0,34 V
Lo ione Cu2+ ha un potenziale standard di riduzione maggiore dello ione Zn2+, quindi il verso spontaneo delle due semireazioni è:
Zn(s) --> Zn2+ + 2 e-...............anodo, polo negativo
Cu2+ + 2 e- <--> Cu(s).............catodo, polo positivo
-----------------------------------------------------------------------
Zn(s) + Cu2+ --> Zn2+ + Cu(s)
Esempio 2
Cu2+ + 2 e- <--> Cu(s).........E° = +0,34 V
Br2(l) + 2 e- <--> 2 Br-.........E° = +1,07 V
Il bromo liquido ha un potenziale standard di riduzione maggiore dello ione Cu2+, quindi il verso spontaneo delle due semireazioni è:
Cu(s) --> Cu2+ + 2 e-.............anodo, polo negativo
Br2(l) + 2 e- <--> 2 Br-............catodo, polo positivo
------------------------------------------------------------------
Cu(s) + Br2(l) --> Cu2+ + 2 Br-
Se si vogliono far avvenire le due redox nel vero non spontaneo opposto bisogna fornire energia elettrica.