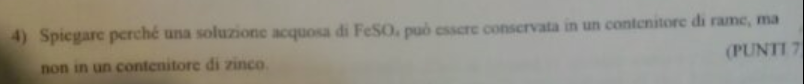matte9595
2017-09-06 08:58
Salve a tutti 
Non riesco a capire come fanno a venire i risultati dell' esercizio :/
L'energia di Gibbs dovrebbe essere data dalla formula G= - ( Ecatodo - Eanodo ) *n*F . Per me nel primo caso non torna che ( Ecatodo - Eanodo ) < 0, perché il catodo dovrebbe essere il rame, mentre l'anodo il ferro quindi prendendo in considerazione i potenziali standard di riduzione a me vengono i seguenti casi :
1_ (0,521-(-0,447)) > 0 e quindi G < 0 ( reazione spontanea )
2_ (0,342-(-0,447)) > 0 e quindi G < 0 ( reazione spontanea )
Come mai non mi torna cosa sbaglio ?  La molecola è FeSO4
La molecola è FeSO4
Grazie in anticipo