WeP
2016-02-10 21:51
Salve, sono uno studente di ingegneria e sto preparando l'esame di fondamenti di chimica.
Non riesco però a risolvere questi esercizi (immagino banali) che posto qui di seguito facendo queste premesse sui simboli che ho utilizzato:
Ho utilizzato 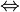 per indicare una reazione all'equilibrio
Kp = costante di equilibrio in funzione delle pressioni parziali
Kc = costante di equilibrio in funzione delle concentrazioni molari
Esercizio 1
Si consideri la reazione: CaCO3(s)
per indicare una reazione all'equilibrio
Kp = costante di equilibrio in funzione delle pressioni parziali
Kc = costante di equilibrio in funzione delle concentrazioni molari
Esercizio 1
Si consideri la reazione: CaCO3(s) 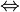 CaO (s) + CO2 (g)
Supponendo di partire con 50g di CaCO3 l'esercizio mi chiede di calcolare la massa all'equilibrio di CaO in due casi:
a) Sistema chiuso T=850°C, Kp=1,23 e V=4L
b) Sistema aperto T=850°C
Nel caso di sistema chiuso ho risolto l'esercizio correttamente, invece non so come procedere nel caso di sistema aperto
Esercizio 2
2CO(g)
CaO (s) + CO2 (g)
Supponendo di partire con 50g di CaCO3 l'esercizio mi chiede di calcolare la massa all'equilibrio di CaO in due casi:
a) Sistema chiuso T=850°C, Kp=1,23 e V=4L
b) Sistema aperto T=850°C
Nel caso di sistema chiuso ho risolto l'esercizio correttamente, invece non so come procedere nel caso di sistema aperto
Esercizio 2
2CO(g) 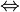 C(s) + CO2(g)
T= 1000 °C P=23,3 atm
Considerando che la miscela all'equilibrio è composta dal 20,44% in peso di CO2 determinare Kc e Kp
Anche in questo caso non so procedere, di solito ho sempre fatto esercizi in cui mi veniva dato il numero di moli (o la massa) iniziale di reagenti e prodotti.
Qualche indizio su come trovare ad esempio ε (coefficiente di avanzamento della reazione) ?
Esercizio 3
CO2(g) +C(s)
C(s) + CO2(g)
T= 1000 °C P=23,3 atm
Considerando che la miscela all'equilibrio è composta dal 20,44% in peso di CO2 determinare Kc e Kp
Anche in questo caso non so procedere, di solito ho sempre fatto esercizi in cui mi veniva dato il numero di moli (o la massa) iniziale di reagenti e prodotti.
Qualche indizio su come trovare ad esempio ε (coefficiente di avanzamento della reazione) ?
Esercizio 3
CO2(g) +C(s) 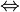 2CO(g)
T=1090,15 K P=0,68 atm
Trovare Kc sapendo che all'equilibrio la frazione molare di CO2 è 0,06.
Grazie in anticipo per gli aiuti
2CO(g)
T=1090,15 K P=0,68 atm
Trovare Kc sapendo che all'equilibrio la frazione molare di CO2 è 0,06.
Grazie in anticipo per gli aiuti  Non c'è bisogno che facciate i calcoli basta anche solo un indizio su come procedere!
Non c'è bisogno che facciate i calcoli basta anche solo un indizio su come procedere!



