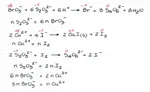Francy1
2018-02-02 15:19
Salve a tutti, ho un esercizio da proporvi..
il rame contenuto in un campione di 0,2500 g di un minerale viene trattato in soluzione acida con un eccesso di KI e lo iodio prodotto viene titolato con 16,50 ml di Na2S2O3. 1,000 ml di tale soluzione titola 0,003619 g di KBrO3 che si riduce a Br- . Qual è la purezza del minerale espressa come percentuale di Cu2S ?
Ho provato a risolverlo in questo modo:
ho calcolato le moli di KBrO3 dai grammi/ PM.
poi ho fatto la proporzione delle moli in 16,50 ml dopo di che ho scritto le reazioni come:
2Cu2+ + 4I- ----> 2CuI + I2
I2 + 2S2O4 ----> 2I- + S4O6
ho fatto la proporzione tra le moli di S2O3 2- e I2 e ho trovato le moli di I2
da ciò la proporzione con Cu2+.
Da qui calcolare la percentuale con i grammi iniziali ma mi trovo un risultato diverso... qualcuno può spiegarmi dove ho sbagliato??? grazie mille a tuttii