Beefcotto87
2012-02-12 16:57
Salve a tutti 
Ultimamente mi è arrivata una spedizione di materiale per microbiologia dalla ditta Biolife di Milano, ed ho quindi deciso di scrivere qui qualche mio esperimento.
Substrato: Pseudomonas Selective Agar
Specifiche Substrato: Idrolizzato pancreatico di gelatina (20 g/L), Magnesio cloruro (1.4 g/L), Potassio solfato (10 g/L), Cetrimide (0.3 g/L), Agar (14 g/L); Terreno selettivo per Pseudomonas spp., che spinge i ceppi di P. aeruginosa a produrre i composti colorati (piocianine e fluoresceina).
Le mie intenzioni sono quelle di isolare e riconoscere il batterio Pseudomonas aeruginosa, o quantomeno arrivarci il più vicino possibile. Che cosa so di questo batterio (escluse specifiche cliniche)? E' un bacillo gram negativo, mobile, non sporulante, aerobio (o anche anaerobio in presenza di nitrati o arginina), tristemente noto per la sua resistenza ad antibiotici, condizioni avverse (cresce in un range di 2-42°C) e disinfettanti (tanto che riesce persino a crescere in dette soluzioni).
Step 1: Trovare il batterio nel suo habitat.
Per il mio esperimento la scelta è ricaduta su due luoghi: il sifone del lavandino della cucina (A) ed il WC (B); con l'uso di due tamponi ho preso del materiale, successivamente gli stessi tamponi sono stati usati per seminare due piastre diverse.
Step 2: Incubazione.
Vista la particolarità del batterio, ho preferito mettere le piastre in incubazione a circa 25°C, piuttosto che 36°C, come consigliato da "Testo Atlante di Microbiologia Diagnostica" di Koneman E. W., in modo da evidenziare la produzione di pigmenti.
Step 3: Prima Valutazione Macroscopica.
Dopo circa 24 ore (ma anche meno) le colonie sono pienamente visibili e producono di già un pigmento verde/giallastro, che suppongo essere pioverdina (fluoresceina). Nella piastra A si sono presentate molte micro-colonie, poi cresciute a dare prima colonie ruvide che ora, in alcune parti, dan vita a colonie dall'aspetto mucoso (confluenti); il colore delle colonie è grigiastro, non riconosco odori particolari (non ho mai sentito il classico "odore d'uva", ma non mi pare ci sia). Nella piastra B la colorazione è nettamente più luminosa, ma sempre gialla (o verde acido), la progressione è la stessa della piastra A; le colonie hanno lo stesso colore, ma si avverte uno spiccato odore putrido, non identificabile (da me, almeno). In nessuna delle due piastre si può notare la colorazione blu/verde da piocianina, ma non nego che possa essere semplicemente un mio errore.

Step 4: Prima Valutazione Microscopica.
La valutazione microscopica è pressochè identica per le due piastre, come c'era da aspettarsi. Si possono notare corti bacilli gram negativi, non ci sono spore. Nel preparato a fresco di entrambe le piastre si può notare la mobilità dei batteri:
Esempio visivo (non fate caso alla musica o al batterio nominato)

Step 5: Primi Test Metabolici.
Piastra A: Catalasi Positive, Ossidasi Positive (la piastra B sembra meno reattiva). Purtroppo non posso fare ulteriori test, ma posso dire che i batteri della piastra B crescono su Agar MacConkey senza dare colonie rosse (debole o assente fermentazione del lattosio).
Considerazioni Finali:
Le prime ipotesi (e vorrei sottolineare che sono puramente ipotesi), mi porterebbero a dire trattarsi di Pseudomonas ssp., non ulteriormente identificabile per ora, produttori di pigmenti giallo/verdi tra 20 e 25 gradi Celsius; Nel prossimo futuro intendo piastrare su Agar Sangue per vedere un'eventuale emolisi, nonchè comprare una lampada ad UV adatta a dimostrare la fluorescenza dei pigmenti presenti.
I seguenti utenti ringraziano Beefcotto87 per questo messaggio: Max Fritz, ale93, jobba, ClaudioG.
E' bellissimo, noi a scuola cercammo tali batteri negli alimenti, ne furono trovato a bizzeffe nell'acqua di superficie di alcuni laghetti da parco, nulla nell'acqua potabile.
Anche io feci un video:
http://www.youtube.com/watch?v=lFnX49m7dfk&feature=channel_video_title
Dott.MorenoZolghetti
2012-02-12 20:30
Beef, nel tuo video non ci sono corti bacilli.
Forse è solo lì per fare un esempio. Non ho capito.
Comunque, la cosa utile senza dubbio è la luce di Wood.
Le colonie di Pseudomonas sull'agar cetrimide crescono bene, rigogliose. Quelle non mi sembrano tanto rigogliose, anche se la temperatura bassa può aver limitato la crescita.
Per la valutazione della motilità ci vuole un apposito vetrino e la tecnica della goccia pendente.
Beefcotto87
2012-02-12 21:20
Il video è un esempio, non posso farne di miei.
Bhe, a me sembrano rigogliose XD è un tappeto di batteri! La piastra A presenta un tappeto mucoso... E' la B che mi pare un po' striminzita, ma dagli tempo! In genere in 48 ore sono ben sviluppati. Come potrei fare a distinguere P. aeruginosa da una qualsiesi Pseudomonas? (fra quelli che han caratteristiche simili, si intende)
Ok, ho delle novità: da una nuova piastra seminata in agar sangue si presenta un odore di ammoniaca, assieme a quello di putrefatto!
Prima di descrivere il prossimo esperimento, vorrei porre delle domande a Er Doc: che tu sappia, quali altri batteri, oltre a S. aureus, possono crescere e fermentare il mannitolo nell'agar sale-mannitolo (dando quindi al terreno una colorazione gialla)? Al contrario, quali batteri possono far variare il colore del terreno sul rosa carico?
Grazie

PS: ma S. aureus, è ossidasi positivo o no? Purtroppo le informazioni in mio possesso sono confusionarie.
Beefcotto87
2012-02-22 21:36
Ho delle foto di Staphylococcus (o Micrococcus) ssp., spero si riesca a vedere qualcosa!

E qui una colorazione di Gram su materiale da follicolo infetto.

Si notano a parer mio pochi cocchi Gram positivi, mentre non capisco cosa sia la fine granulazione viola (parti di batterio?)
Beefcotto87
2012-02-24 14:55
Esperimento n°2:
Substrato: Mannitol-Salt Agar (Chapman)
Specifiche Substrato: Mannitolo (10 g/L), NaCl (75 g/L), Peptone (10 g/L), Estratto di carne (1 g/L), Rosso fenolo (0.025 g/L), Agar (15 g/L); Terreno selettivo-differenziale per l’isolamento di Staphyloccoccus ssp. ed il differenziamento di S. aureus (fermentazione del mannitolo con produzione di acidi e quindi colorazione gialla del mezzo) da altri Staphylococchi (nessuna colorazione o colorazione diversa) e da Micrococchi (nessuna colorazione del mezzo).
Le mie intenzioni sono quelle di isolare e riconoscere il batterio Staphylococcus aureus, o quantomeno arrivarci il più vicino possibile. Di questo batterio si sa che: è un cocco gram positivo che si dispone a "grappoli", è anaerobio facoltativo, immobile, asporigeno e che produce antiossidanti che danno alle colonie il classico colore giallo-aranciato, nell'ambito della biochimica è catalasi positivo, ossidasi negativo, coagulasi positivo e fermenta il mannitolo con produzione di acidi. In ambito medico sono famosi i ceppi multiresistenti, che causano malattie purulente, intossicazioni alimentari, setticemie, ecc... In base al ceppo.
Step 1: Trovare il batterio nel suo habitat.
Purtroppo per questo esperimento ho fatto diverse ricerche, per ora infruttuose: ho preso tamponi orali, da cute esposta, da cute non esposta, da mammiferi e da tamponi su mucosa nasale (il tutto in assenza di infezioni note, ovviamente), un campione con pus follicolare. Tutte, tranne le piastre seminate col tampone nasale, non han mostrato la comparsa di colorazione gialla del mezzo in maniera apprezzabile, mentre qualche colonia separata ha dato esito positivo sul terreno.
Step 2: Incubazione.
Incubazione in Agar Sale-Mannitolo e Agar Sangue per evidenziare colorazione del mezzo nel primo ed emolisi eventuale nel secondo: tutte le piastre sono state incubate a 30-35°C in aerobiosi.
Step 3: Prima Valutazione Macroscopica.
Dopo circa 24 ore (ma anche meno) le colonie sono pienamente visibili e varie, escludendo quelle che non colorano il mezzo e quelle che lo colorano in fuchsia carico, una sola è risultata positiva alla fermentazione del mannitolo (terreno giallo, tampone nasale). Nella piastra la colonia è stata prontamente isolata e riportata in una nuova piastra Sale-Mannitolo, in cui si può vedere una forte colorazione gialla: le colonie appaiono tonde, cremose, piccole (1-2 mm), traslucide e a margine regolare, colore giallo crema chiaro senza odori particolari. La piastra di agar sangue deve ancora svilupparsi.
Step 4: Prima Valutazione Microscopica.
I batteri sono immobili, alla colorazione di gram si notano cocchi Gram positivi posti in grossi grappoli, coppie ed elementi singoli, a volte anche corte catene. Già questa prima analisi può far venire il dubbio non si tratti di S. aureus (non mi pare formi catenelle). NB: le macchie rosse sono residui del terreno o del vetrino, molto probabilmente!

Step 5: Primi Test Metabolici.
Catalasi negativo, Ossidasi negativo, Fermentazione del Mannitolo positivo, impossibilità di effettuare il test di Coagulasi. Su agar sangue si presenta una debole alfa-emolisi, il chè fa propendere per l'ipotesi n°1.
Ipotesi Finali: Dopo la contentezza iniziale, mi trovo frustrato nel comprendere che potrebbe essere un altro batterio! A questo punto le ipotesi sono due: 1- trattasi di Enterococcus ssp. (faecalis o faecium), che appartenendo alla famiglia degli Streptococchi, risulta catalasi negativo, mentre forma catene o coppie da terreno solido alla visione microscopica, ed al contrario degli altri Streptococchi riesce a crescere ad alti livelli di salinità, fermentando oltretutto il mannitolo; 2- Ipotesi vagamente fantascientifica, ma potrebbe essere una sottospecie, S. aureus subsp. anaerobius, che risulta catalasi negativa e con scarsa crescita in aerobiosi (http://ijs.sgmjournals.org/content/35/1/99.short), anche se in rete (quindi, prendetela con le molle) si parla spesso di Staphylococchi di interesse medico catalasi-negativi (http://fad.italbioforma.it/P3.asp?varIdNws=2061)... Non conosco purtroppo altre caratteristiche di questo batterio.
I seguenti utenti ringraziano Beefcotto87 per questo messaggio: Max Fritz
Beefcotto87
2012-02-26 10:57
Dopo aver inoculato altre piastre, sono forse riuscito ad avvicinarmi al tanto agognato S. aureus! Per non stare a ripetere quanto ho già scritto prima, vi scriverò solo le differenze (l'analisi è stata fatta su due piastre, come al solito, A e B, ma sostanzialmente i risultati sono gli stessi!).
Alla visione microscopica si possono vedere varie aggregazioni di cocchi:
 A
A  B
B
Ai test metabolici si riscontra una marcata catalasi, ossidasi negativa, fermentanti il mannitolo. Tutte le colonie presentano una colorazione giallo carico; a breve inoculazione su piastra di agar sangue.
Dott.MorenoZolghetti
2012-03-01 20:18
Adoro questi sublimi pasticci. Inutili.
Per lo S. aureo ci vuole il test della coagulasi.
E magari una bella colorazione di Gram.
Quelli in foto come sono colorati?
Beefcotto87
2012-03-01 20:33
Come già scritto, si... I colori chiari o scuri sono dovuti all'illuminazione maggiore o minore, per le foto. Si, purtroppo non mi è possibile utilizzare quel test, nè altri, a quanto pare... Io mi ci diverto e faccio quanto posso! Avessi macchinari, sostanze e un laboratorio sarebbe un altro discorso
Si, con la mia centrifuga da 7000 € ottengo il plasma... -.-'
Dott.MorenoZolghetti
2012-03-01 22:36
Beh, se quella è una colorazione di Gram, non sono cocchi G+, ma cocchi G-, quindi non certo stafiloccocchi, nè streptococchi.
Per il plasma, lo vendono già pronto, liofilizzato. Una volta, circa 100 anni fa, si ricorreva al salasso, ora si usa internet e una carta di credito. 
Beefcotto87
2012-03-02 07:50
Spero tu stia scherzando O.O Gram negativi? Guarda la foto degli Pseudomonas, a me sembra una cosa completamente diversa! Lo so ch lo vendono, ma costa... Magari alla prossima infornata di prodotti.
Dott.MorenoZolghetti
2012-03-02 16:45
Nell'ultima foto io vedo rosso, non blu!
Beefcotto87
2012-03-02 16:46
Deve essere un problema o del PC o dell'occhio, ma ti assicuro che di rosso ci sono solo tracce! Probabilmente è un po' di terreno tirato su!
Dott.MorenoZolghetti
2012-03-02 16:48
Una fiala da 1 mL del mio migliore plasma liofilo costa 5 Euro. Se vuoi ti faccio da garante per chiedere un finanziamento alla Banca Popolare di Novara!
Beefcotto87
2012-03-02 16:53
COAGULASE PLASMA EDTA
LF - 60 test 429938 10 x 1 ml (3ml) 54,50 €
LF - 60 test 429937 4 x 2,5 ml (7,5ml) 33,70 €
Questo è il minimo che mi dà l'azienda da cui compro. Non è propriamente economico... Senza contare che poi magari ti dicono "minimo 5 ordini"...
Dott.MorenoZolghetti
2012-03-02 20:05
Perdonami, ma non potresti fare altro che il medico: non sai leggere.
Una fiala da 1 mL di plasma liofilo... 5 euro, non 50 euro...
Beefcotto87
2012-03-02 20:08
Se me la vendi tu certo  Altrimenti quelli son i prezzi
Altrimenti quelli son i prezzi 
Beefcotto87
2012-04-22 14:19
Ultimamente sto coltivando uno Streptococco, grazie ad una mia amica! Appena avrò seguito l'iter che uso di solito, scriverò di questo!
Se tutto va come deve andare, sarà il mio primo vero "bastardello", motivo per cui sto usando tutte le misure possibili per evitare contaminazioni (cosa che comunque faccio sempre...)
Dott.MorenoZolghetti
2012-04-22 17:30
Bravo bravo...ci diamo alle armi biologiche...
Scarlattina per tutti i novaresi!
Beefcotto87
2012-04-23 12:40
Esperimento n° 3
Substrato: Blood Agar Sheep
Specifiche Substrato: Triptone 14.5 g/l, Peptone 5.0 g/l, NaCl 5.0 g/l, Agar agar 14.0 g/l, Fattori di crescita 1.5 g/l, Sangue defibrinato di montone 5% per litro. Terreno differenziale per batteri non esigenti, per uso generale.
Le mie intenzioni sono quelle di isolare il batterio Streptococcus pyogenes. Che cosa so di questo batterio (escluse specifiche cliniche)? E' un cocco gram positivo, immobile, non sporulante, anaerobio facoltativo, noto per portare infezioni purulente, scarlattina ed indirettamente (ed in assenza di cure antibiotiche) glomerulo-nefriti e febbre reumatica.
Step 1: Trovare il batterio nel suo habitat.
Per il mio esperimento mi è stato utilissimo l’aiuto di un’amica, che mi ha permesso di tamponarle la faringe in corso di faringite streptococcica (già diagnosticata, il ché mi ha aiutato enormemente!) prima della cura antibiotica.
Step 2: Incubazione.
Una iniziale piastra di agar sangue di montone è stata seminata direttamente col tampone faringeo ed incubata a 35°C per 24 ore in aerobiosi; successivamente le colonie sospette sono state riportate su una nuova piastra ed incubate normalmente.
Step 3: Prima Valutazione Macroscopica.
Dopo circa 24 ore (ma già dopo 5 ore) nella prima piastra si nota la presenza di flora mista a maggioranza β-emolitica, nella fattispecie si possono distinguere tre tipologie: 1- Colonie di piccole dimensioni (da < 1mm a 1 mm), traslucide, grigiastre, β-emolitiche, lisce e tonde (in maggior numero); 2- Colonie rugose, irregolari/lobate, grigio-giallastre, completamente opache, asciutte, non emolitiche, di circa 1-2mm; 3- Colonie varie, verosimilmente di Staphylococchi ed altri batteri della flora residente. Nella seconda piastra, quella di mantenimento, sono presenti solo colonie del tipo 1 (occasionalmente qualche colonia Staphylococcica da contaminazione). Solo le colonie di tipo 1 verranno considerate per questo caso


Step 4: Prima Valutazione Microscopica.
La valutazione microscopica mostra la presenza di cocchi Gram positivi disposti a corte catene e/o a coppie, probabilmente l’omogeneizzazione del campione su vetrino ha portato a rottura delle lunghe catene solite di questa specie. Mobilità e spore sono parametri non valutati in ragione delle altre prove.

Step 5: Primi Test Metabolici.
Entrambe le piastre: Catalasi negative, Ossidasi negative, Presenza di emolisine e mancata crescita in Agar Sale-Mannitolo (per escludere enterococchi); avrei voluto attuare il test CAMP (sigla derivante dai nomi degli scopritori, Christie, Atkins, Munch-Peterson) per distinguere gli streptococchi di gruppo A di Lancefield da quelli di gruppo B, ma non possiedo purtroppo il materiale necessario.
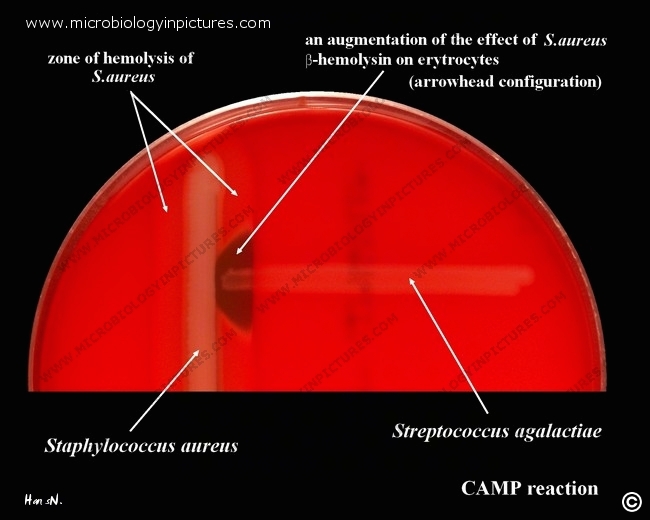
Test CAMP con uno streptococco di tipo B. Il test vedrò di spiegarlo in futuro 
Considerazioni Finali:
Grazie all'aiuto delle analisi già avvenute, ho una discreta sicurezza nel dire di aver isolato S. pyogenes; visto il pericolo di questo patogeno, le piastre, il materiale usato ed i vetrini verranno sanitizzati e/o bruciati subito dopo i test: vorrei ricordare che tutti questi esperimenti sono stati condotti con l'uso di precauzioni massime in modo da evitare il più possibile contaminazioni verso la mia persona o verso oggetti.
Beefcotto87
2012-05-01 13:48
Nelle vecchie piastre si sono sviluppate ampie colonie di Penicillum ssp., lo dico solo come curiosità!







 A
A  B
B



