richy2011
2011-04-21 19:31
Cosa è l'insulina ?
- L'insulina è un ormone , cioè una molecola di derivazione proteica , che viene prodotto , nel nostro corpo, dal pancreas .
La struttura è qui rappresentata :

In questa struttura ovviamente non sono rappresentati gli atomi o radicali che compongono la struttura quindi scriverò la formula bruta di seguito :
C254-H377-N65-O76-S6
Viene prodotto dalle cellule beta nelle cosidette isole Langerhans , i quali sono le "fabbriche" addette alla produzione di ormoni pancreatici.
Come si producono le molecole di insulina?
- Le cellule beta nella prima fase di biosintesi fisiologica dell'insulina producono una specie di prototipo di insulina la quale verrà poi sintetizzata e trasformata per l'appunto in insulina attiva. Questo prototipo che noi chiameremo "pre-insulina". Questa pre-insulina viene letteralemnte scissa in un nuovo ormone ancora inattivo biologicamente che chiameremo "pro-insulina".Degradando un'ultima volta questa molecola arriveremo all'insulina , un ormone fortemente attivo biologicamente.
La sua formula è C254H377N65O76S6, questi atomi vengono diposti lungo due catene , organizzati in aminoacidi, legati tra loro con legami "disolfuro" , che riguardano gli atomi di zolfo delle catene in questione.
Uno di questi legami è presente anche nella prima catena stessa. La prima catena contiene 21 aminoacidi mentre la seconda ben 30.L'insulina è un peptide.Queste molecole poi vengono immagazzinate nelle cellule beta per avere una riserva continua in caso di necessità.
Come agisce l'insulina nel nostro organismo?
- L'insulina viene rilasciata nel nostro organismo dalle cellule beta che le producono e le contengono, in caso di innalzamento della glicemia sanguigna. Alcuni ormoni intestinali, alcuni aminoacidi o sostanze dette solfaniluree sono, inoltre, in grado di far rilasciare questo peptide.
L'insulina ha diverse funzioni nel nostro organismo :
-Trasporto di glucosio e aminoacidi
-Sintesi del glicogeno
-Sintesi degli acidi nucleici
-Conversione del glucosio in trigliceridi
Il trasporto di glucosio e di aminoacidi consiste nel facilitare l'entrata del glucosio e degli aminoacidi nelle cellule.
La sintesi del glicogeno consiste nel sintetizzare il glicogeno , un carboidrato polisaccaride , che viene definito un'ampia riserva di energia poichè viene sintetizzata dall'insulina direttamente dal glucosio assunto e non utilizzato immediatamente dall'organismo.
La sintesi degli acidi nucleici consiste nell'anabolizzare le reazioni presenti negli acidi nucleici.
La conversione del glucosio in trigliceridi consiste nel convertire le molecole di glucosio non sintetizzate in glicogeno, in trigliceridi. Essi sono grassi ciò implica una riserva di energie pressochè doppia rispetto ai carboidrati.
Come viene prodotta in laboratorio?
- La maggiorparte delle insuline prodotte in laboratorio sono prodotte usando la tecnologia genica (DNA ricombinante). Si possono utilizzare per la sintesi di insulina sia cellule di lievito sia batteri (normalmente si usa l' E. Coli) i quali ricevono le informazioni dai geni impiantati artificialmente. Queste informazioni rendono possibile la sintesi in quanto "programmano" le cellule a formare insulina. Questa tecnica funziona nel seguente modo :
- Si isola il gene dell'insulina e un plasmide
- Si tagliano entrambe le sequenze con lo stesso enzima di restrizione che crea delle estremità coesive sia nel DNA sia nel plasmide
- Il segmento di Dna viene mescolato con il plasmide tagliato. Le basi azotate delle estremità coesive del plasmide si appaiano con quelle delle estremità complementari del frammento di DNA dell'insulina
- L'enzima DNA-ligasi unisce mediante legami covalenti le due molecole di DNA
Il risultato è un plasmide ricombinante che viene inserito in un batterio e se le condizioni ambientali sono buone, il batterio preleverà il DNA plasmidico. È importante dire infatti che la sintesi dell’insulina è attuata partendo dalla sintesi separata delle due catene peptidiche A e B che vengono in un secondo tempo unite con ponti disolfuro. Vi è anche un secondo metodo nel quale si sintetizza una molecola identica a quella della proinsulina che può venire impiegata come tale oppure sottoposta all’azione enzimatica con scissione del peptide C. A questo punto i batteri vengono messi in grandi serbatoi, detti bioreattori, insieme ad una soluzione nutritiva e in condizioni ambientali idonee alla loro crescita. Queste cellule rilasciano l’insulina prodotta nella soluzione nutritiva, da cui l’insulina deve essere poi esclusivamente estratta. L’insulina ottenuta è molto pura e con una struttura identica a quella umana.
Gli analoghi dell'insulina umana
Lo scopo della ricerca è di sviluppare dei preparati insulinici che presentino una migliore efficacia fisiologica e che mirino a un migliore controllo della glicemia. Questo ha portato allo sviluppo degli analoghi dell’insulina umana. Per fare agire l’insulina in modo che riproduca al meglio l’azione propria dell’organismo, vengono modificate alcune parti della struttura proteica dell’insulina umana prodotta. Questi analoghi si basano sulla durata e sulla velocità di azione dell’insulina in grado di riportare più facilmente la glicemia di una persona con un metabolismo degli zuccheri a concentrazioni normali. Questi analoghi prendono il nome di insulina ultralenta e insulina ultrarapida. Le molecole di insulina in soluzione hanno la tendenza a formare dimeri perché vi sono
legami a idrogeno tra i residui C-terminali delle catene B e, in presenza di ioni zinco, questi dimeri di insulina tendono ad associarsi formando degli esameri. Queste interazioni hanno importanti conseguenze cliniche perché i monomeri e i dimeri diffondono rapidamente nel sangue, mentre gli esameri lo fanno meno efficacemente. Le preparazioni di insulina regolare usate per il trattamento dei diabetici hanno un elevata percentuale di esameri e solo ogni singola molecola di insulina è biologicamente attiva, cosicché, per renderla attiva, l'organismo deve prima interrompere i legami tra le sei molecole di insulina. Le singole molecole diventano così disponibili nel giro di circa 30 minuti. Per questo, l’industria farmaceutica ha deciso di utilizzare l’insulina ricombinante cambiando i risvolti di lisina e prolina C-terminali (lisina è rappresentata dalla scritta “Lys” e prolina da “Pro”) delle catene B: questo riduce la tendenza a costituire dimeri ed esameri ma non altera il legame insulina-recettore e l’insulina inizia ad agire appena iniettata. Questa insulina è un’analoga che prende il nome di ultrarapida ed un esempio è l’insulina Lispro®. Le insuline ultralente funzionano invece in modo diverso: sono modificate grazie alla tecnologia del DNA ricombinante per avere un’azione costante (che duri 12 o 24h) ed entrare lentamente nella circolazione sanguinea. Esistono due tipi:
detemir (di durata 24h) e glargine (di durata 12h).
Nella glargine è stata attuata la sostituzione dell'asparagina con la glicina nella posizione 21 della catena A e l’aggiunta di due arginine nell'estremità terminale C della catena B. Questo consente, grazie alla presenza di zinco, una cristallizzazione. In questo modo, al contrario dell’insulina ultrarapida, si formeranno molti esameri che, uniti, daranno luogo a cristalli che permetteranno un assorbimento lento dell’insulina.
Ecco alcune foto di una siringa preriempita usata per terapie nel caso di pazienti affetti da diabete melliti di 1o tipo :
http://www.facebook.com/photo.php?fbid=1727238544321&set=a.1481782208066.2067693.1339143558&type=1&theaterSiringa numero 2




 mi sembra stupido anche parlarne...
mi sembra stupido anche parlarne...
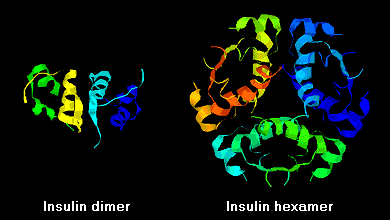 Queste interazioni hanno importanti ramificazioni cliniche. I monomeri e i dimeri diffondono rapidamente nel sangue, mentre gli esami davvero poco. Perciò, l'assorbimento di preparazioni insuliniche contenenti un elevata % di esameri è ritardata e in qualche modo lenta. Questo fenomeno, tra gli altri, ha stimolato lo sviluppo di un numero di analoghi dell'insulina ricombinanti. La prima di queste molecole ad essere marcata - chiamata insulina lispro - è stata progettata in modo che i residui C-terminali di lisina e prolina alla fine della catena B fossero invertiti; questa modificazione non altera il legame recettore, ma minimizza la tendenza a formare dimeri ed esameri.
Queste interazioni hanno importanti ramificazioni cliniche. I monomeri e i dimeri diffondono rapidamente nel sangue, mentre gli esami davvero poco. Perciò, l'assorbimento di preparazioni insuliniche contenenti un elevata % di esameri è ritardata e in qualche modo lenta. Questo fenomeno, tra gli altri, ha stimolato lo sviluppo di un numero di analoghi dell'insulina ricombinanti. La prima di queste molecole ad essere marcata - chiamata insulina lispro - è stata progettata in modo che i residui C-terminali di lisina e prolina alla fine della catena B fossero invertiti; questa modificazione non altera il legame recettore, ma minimizza la tendenza a formare dimeri ed esameri.
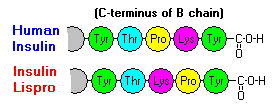 L'insulina è sintetizzata in quantità significative solo nella cellule beta nel pancreas. L'insulina mRNA è tradotta come un precursore a catena singola chiamato preproinsulina, e la rimozione di questo peptide segnale durante l'inserzione nel reticolo endoplasmatico genera la proinsulina.
L'insulina è sintetizzata in quantità significative solo nella cellule beta nel pancreas. L'insulina mRNA è tradotta come un precursore a catena singola chiamato preproinsulina, e la rimozione di questo peptide segnale durante l'inserzione nel reticolo endoplasmatico genera la proinsulina.
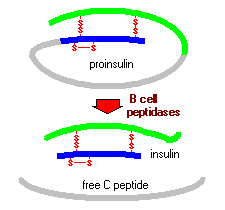 La proinsulina è formata da tre domini: una catena B che termina con un gruppo amino, un caterna A che termina con un gruppo carbossile e un peptide che fa da linker nel mezzo noto come peptide C. All'interno del reticolo endoplasmatico, la proinsulina è esposta a diverse endopeptidasi specifiche che asportano il peptide C, generando quindi la forma matura dell'insulina. L'insulina e il peptide C libero sono racchiusi nel Golgi in granuli secretori che accumulano nel citoplasma.
Quando la cellula beta è stimolata appropriatamente, l'insulina è secreta dalla cellula attraverso l'esocitosi e diffonde nel sangue capillare. Il peptide C è quindi secreto nel sangue, ma non ha attività biologica nota.
La proinsulina è formata da tre domini: una catena B che termina con un gruppo amino, un caterna A che termina con un gruppo carbossile e un peptide che fa da linker nel mezzo noto come peptide C. All'interno del reticolo endoplasmatico, la proinsulina è esposta a diverse endopeptidasi specifiche che asportano il peptide C, generando quindi la forma matura dell'insulina. L'insulina e il peptide C libero sono racchiusi nel Golgi in granuli secretori che accumulano nel citoplasma.
Quando la cellula beta è stimolata appropriatamente, l'insulina è secreta dalla cellula attraverso l'esocitosi e diffonde nel sangue capillare. Il peptide C è quindi secreto nel sangue, ma non ha attività biologica nota.