al-ham-bic
2011-07-11 21:01
Ecco un "giochetto" estivo: con una semplice pila zinco-carbone e una bella giornata può presentarsi l'occasione per studiare un po' la chimica del manganese, non sempre ben conosciuta (Treadwell docet!).
Sarò sintetico, altrimenti anche stavolta il post verrebbe lungo.
1- Smontare completamente una pila zinco-carbone formato torcia (quelle più grosse, dalla quale si può anche recuperare l'utile elettrodo di carbone) separando i tre componenti, zinco, carbone, miscela elettrolitica nera.
2- La miscela elettrolitica è costituita da MnO2, carbone e NH4Cl.
A noi interessa il manganese, che va pertanto separato. L'unico modo per farlo è solubilizzare il biossido (separandolo dal carbone) e precipitarlo come insolubile (separandolo dal resto). Eventuali impurezze presenti ci interessano relativamente in questo contesto.
3- Porre in un becker da 600 ml la massa nera e, ALL'APERTO, aggiungere 100 ml di HCl conc., mescolando bene ogni tanto.
Si ha svolgimento di cloro, secondo la reazione:
MnO2 + 4 HCl --> MnCl2 + Cl2 + 2 H2O
Alla fine riscaldare un pochino per essere sicuri che tutto il manganese sia stato solubilizzato.
4- Diluire la brodaglia nera con 500 ml di aqua mescolando bene e lasciar decantare pazientemente. Il carbone si separa (un po' galleggia, il resto va in basso).
Quando la soluzione ha riposato quanto basta, pipettare con attenzione il liquido, che deve risultare perfettamente limpido, senza traccia di carbone.
5- Ora precipitiamo il manganese come idrossido con NaOH, prima neutralizzando l'HCl in eccesso e poi fino a reazione neutra.
MnCl2 + 2 NaOH --> Mn(OH)2 + 2 NaCl
e qui comincia il bello, perchè l'idrossido di manganese puro (bianco) è estremamente difficile da ottenere (si fa con altri
metodi e in atmosfera inerte) in quanto esso assorbe ossigeno dovunque si trovi trasformandosi parzialmente in manganito
manganoso (marrone scuro) secondo le reazioni:
2 Mn(OH)2 + O2 --> 2 H2MnO3 l'acido manganoso reagisce subito con l'idrossido formando il suo sale
H2MnO2 + Mn(OH)2 --> Mn[MnO3] + 2 H2O
6- Si nota infatti che il precipitato di Mn(OH)2 si colora quasi immediatamente in marroncino
L'ossidazione è solo parziale ed aspettare che coinvolga tutta la massa sarebbe troppo lungo, allora...
7- L'ossidazione è totale ed istantanea con vari ossidanti, fra i quali gli ipocloriti, secondo la reazione:
Mn(OH)2 + ClO- --> H2MnO3 + Cl-
quindi aggiungere mescolando 200 ml di NaClO al 5%, notando che istantaneamente tutta la massa si colora quasi di nero
8- Lasciar sedimentare anche stavolta (anzi più e più volte!) lavando ogni volta con 500 ml di acqua.
Alla fine filtrare (con molta difficoltà ed in fasi ripetute!) su buchner il precipitato scuro e lasciar asciugare. La resa è stata di 16 g.
Questa è la parte più difficile, molto lunga e noiosa.
9- Il manganito manganoso Mn2O3 (NON è l'ossido del manganese trivalente, è Mn[MnO3]!) si presenta come una polvere marrone
che naturalmente essendo partiti da una volgare pila non avrà purezza analitica (contiene un po' di ferro).
[Si possono però poi ottenere i sali del manganese puri con una procedura noiosetta che mi ha impegnato una montagna di tempo e che magari dirò].
10- I sali del manganese trivalente sono pochissimi e poco stabili (solo alcuni complessi) e si possono formare dal manganito manganoso; l'unico sale Mn+++ facile e almeno visibile per un po' è il fosfato MnPO4, di colore viola intenso.
Sciogliere in una capsulina una puntina di spatola di manganito manganoso con qualche ml di acido fosforico concentrato:
Mn[MnO3] + 2 H3PO4 --> 2 MnPO4 + 3 H2O
Si ha parziale soluzione e colorazione viola.
Notare che dopo pochi minuti il colore viola tende a virare a grigio e si ha precipitazione di fosfato di manganese "normale" Mn++ stabile.
Il post è venuto lungo nonostante il riassunto... ma chi volesse "giocare" con le pile ha ora del materiale in più.
I seguenti utenti ringraziano al-ham-bic per questo messaggio: arkypita, **R@dIo@TtIvO**, ale93, Franc, jobba, Max Fritz, Dott.MorenoZolghetti, as1998, Publios Valesios, Capux, fosgene, luigi_67, TrevizeGolanCz, Hamiltoniano, Igor, ClaudioG., None, AminewWar, AndreaChem






 ) anche del manganito manganoso ! Solo per essere precisi.. di che marca era la tua pila zinco carbone?
) anche del manganito manganoso ! Solo per essere precisi.. di che marca era la tua pila zinco carbone? 
 (oltre che dei più introvabili al giorno d'oggi, a parte chi ce l'ha...).
(oltre che dei più introvabili al giorno d'oggi, a parte chi ce l'ha...). anche per questo)
anche per questo) perché non capisco. se al ti ha ripetuto una cosa fornendoti anche fonte autorevole non capisco perché continui con questo metodo
perché non capisco. se al ti ha ripetuto una cosa fornendoti anche fonte autorevole non capisco perché continui con questo metodo 

 Ma non capisco cosa sia il "biossido di manganese idrato".
I potenziali redox di questo composto non li so di certo.
---
Ho aggiunto ipoclorito stimando di ossidare tutto l'Mn(OH)2; se ce ne fosse in eccesso va poi via tutto con i solubili. Se fosse in difetto l'idrossido si ossiderebbe comunque all'aria pian piano.
---
Il comportamento è diverso (oltre che il colore) dal MnO2 perchè per alluminotermia reagisce in maniera molto più blanda del biossido ed è una partenza per ottenere con questo metodo il manganese (ho fatto un piccolo test in questo senso per vedere la reattività, per fare l'Mn ce ne vorrebbe un bel mucchietto e dovrebbe essere ben puro).
---
Chimico, fai bene a mettere sempre la pulce: è uno stimolo a stare attenti a quel che si dice...
Ma non capisco cosa sia il "biossido di manganese idrato".
I potenziali redox di questo composto non li so di certo.
---
Ho aggiunto ipoclorito stimando di ossidare tutto l'Mn(OH)2; se ce ne fosse in eccesso va poi via tutto con i solubili. Se fosse in difetto l'idrossido si ossiderebbe comunque all'aria pian piano.
---
Il comportamento è diverso (oltre che il colore) dal MnO2 perchè per alluminotermia reagisce in maniera molto più blanda del biossido ed è una partenza per ottenere con questo metodo il manganese (ho fatto un piccolo test in questo senso per vedere la reattività, per fare l'Mn ce ne vorrebbe un bel mucchietto e dovrebbe essere ben puro).
---
Chimico, fai bene a mettere sempre la pulce: è uno stimolo a stare attenti a quel che si dice... 



 Complimenti
Complimenti






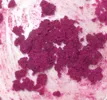

 Mn(OH)2
Mn(OH)2




