quimico
2011-11-14 15:38
I composti contenenti il gruppo funzionale chetonico o aldeidico sono importanti in chimica organica.
Essi sono comuni in natura e sono spesso intermedi chiave nella sintesi organica. I metodi utili per la preparazione di chetoni includono il coupling di cloruri acilici con reagenti organozinco, l'aggiunta di reagenti organomagnesio ad ammidi di Weinreb e l'idratazione di alchini.
Le aldeidi possono essere preparate tramite riduzioni di cloruri acilici o esteri con certi idruri metallici o tramite idrogenazione catalitica.
Nonostante i numerosi metodi di preparazione, l'unico più importante metodo per la preparazione sia chetoni che aldeidi è l'ossidazione di alcoli. Gli alcoli sono tra i composti organici più facilmente disponibili, e quindi, questo metodo per la preparazione di aldeidi e chetoni è estremamente utile.
Alcoli primari e secondari sono ossidati alle corrispondenti aldeidi e chetoni tramite diversi agenti ossidanti, quali ad esempio Na2Cr2O7 o KMnO4.
Le aldeidi derivate da alcoli primari possono essere ulteriormente ossidate ad acidi carbossilici da alcuni di questi agenti, mentre i chetoni derivati da alcoli secondari sono stabili ad un'ulteriore ossidazione, o per meglio dire non possono essere ulteriormente ossidati.
Storicamente, uno dei più diffusamente usati agenti ossidanti è stato l'acido cromico, che è preparato miscelando sodio dicromato con acido solforico. I sali di cromo, comunque, sono sospetti mutageni, cancerogeni, ed estremamente corrosivi. Esistono per questo regole ferree sull'utilizzo, lo stoccaggio e lo smaltimento di tali sali.
L'acido ipocloroso (HOCl), un agente ossidante alternativo, è facilmente disponibile, non costoso, discretamente sicuro, e non particolarmente dannoso per l'ambiente se comparato ai reagenti che usano cromo o manganese.
HClO è un ossidante più forte del cloro in condizioni standard:
2 HClO(aq) + 2 H+ + 2 e−  Cl2(g) + 2 H2O E = +1.63V
Cl2(g) + 2 H2O E = +1.63V
Sebbene HOCl sia instabile e decomponga lentamente durante il suo stoccaggio, esso può essere preparato da un reagente disponibile in ogni casa: la candeggina, una soluzione di sodio ipoclorito al 5.25%. Il sodio ipoclorito per trattamento con acidi acetico glaciale produce l'acido ipocloroso, secondo la reazione:
NaClO + CH3COOH → HClO + CH3COONa
In questo esperimento, una miscela di candeggina ed acido acetico glaciale verrà usata per preparare il cicloesanone dal cicloesanolo; questa ossidazione, anche se vi sembrerà strano, porta il nome delle persone che l'hanno scoperta: Chapman e Stevens. Tra l'altro ho qui sotto mano l'articolo, e devo dire che è abbastanza geniale come idea...
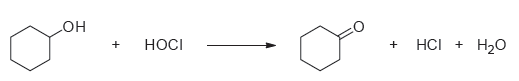
Il meccanismo non è purtroppo ancora stato accertato, ma si pensa che in presenza di acidi (in questo caso quello acetico), l'acido ipocloroso si protoni e vada ad attaccarsi al gruppo −OH dell'alcole da ossidare, formando un ipoclorito organico, ed eliminando un molecola d'acqua. Essendo in soluzione acquosa, l'acqua attacca l'ipoclorito e dopo due step in cui si elimina acqua acida, si ha formazione del chetone.
Per controllare che la reazione tra HClO e cicloesanolo sia andata a completezza, l'HClO deve essere in eccesso durante la reazione. Poiché la concentrazione di ioni ClO− nella candeggina varia, la presenza di un eccesso di HClO non può essere assunta aggiungendo un eccesso basato sulla quantità molare di cicloesanolo ed assumendo che la candeggina contenga il 5.25% di NaClO.
Invece, la presenza di HClO deve essere stabilita tramite un test chimico, il test con KI/amido. Questo test impiega carta impregnata di KI e amido; una goccia della miscela di reazione è posta sulla carta. Se è presente HClO, esso ossida lo ione ioduro nella cartina a iodio, che in quest caso forma un complesso blu-nero con l'amido secondo la reazione:
HOCl + H+ + 2 KI (in presenza di amido) → 2 KCl + H2O + I2-amido (complesso)
Alla fine della reazione, qualsiasi eccesso di agente ossidante deve essere distrutto. Questo viene ottenuto tramite aggiunta di NaHSO3 che riduce l'eccesso di ossidante secondo la reazione:
HClO + NaHSO3 → HCl + NaHSO4
Per determinare se è stato aggiunto abbastanza NaHSO3, la miscela di reazione è di nuovo testata come sopra; questa volta l'assenza di HClO è il risultato desiderato.
Dopo neutralizzazione con NaOH, il cicloesanone viene addizionato di NaCl solido. L'aggiunta di NaCl solido o di salamoia è una pratica comune in chimica organica, basata sul principio che sali inorganici dissolti diminuiscono la solubilità della maggior parte dei composti organici in acqua. Il cicloesanone è estratto in diclorometano e la risultata reazione trattata con un agente disidratante e fatta evaporare tramite legger riscaldamento. Cicloesanone ad una maggiore purezza può essere ottenuto previa distillazione del grezzo, ma non è questo un passaggio essenziale.
ATTENZIONE!
L'acido acetico glaciale e il sodio ipoclorito concentrato sono corrosivi per la pelle. Evitare quindi il contatto con la pelle. Se venissero in contatto con la pelle lavarsi subito le mani con acqua corrente e nel caso consultare un medico. Vorrei inoltre ricordare che il diclorometano è sospetto cancerogeno. Indossare sempre guanti, occhiali ed indumenti protettivi. Cicloesanolo e cicloesanone sono irritanti — evitare il contatto con la pelle.
Procedura:
Porre 10 mmol di cicloesanolo ed un'ancoretta magnetica in una beuta, posta su un agitatore meccanico ed agitare mentre con cautela vengono aggiunti 2.5mL di acido acetico glaciale.
Versare 15mL di NaClO (ca. al 5.25%, comune candeggina) in un imbuto gocciolatore o separatore, posizionare tale imbuto sopra la beuta, ed aggiungere tale reagente goccia a goccia alla miscela cicloesanolo/acido acetico. L'aggiunta dovrebbe durare 10-15 minuti.
Se la beuta dovesse diventare calda al tatto durante l'aggiunta, rallentare la velocità di gocciolamento e usare un bagno di ghiaccio per raffreddare il tutto.
Quando l'aggiunta è completa, la soluzione dovrà essere colorata da giallo paglierino a giallo-verde. Testare la soluzione per l'eccesso di HClO e, se necessario, aggiungere ulteriore NaClO.
Agitare la miscela di reazione per 15 minuti a temperatura ambiente. Quindi, quenchare l'eccesso di ossidante aggiungendo 10-20 gocce di una soluzione satura di NaHSO3 (30 g in 100mL di acqua).
Testare la reazione per HClO e, se necessario, aggiungere ulteriore NaHSO3.
Aggiungere 2 gocce di blu timolo, e quindi aggiungere NaOH 6N con una pipetta finché la soluzione vira a blu chiaro (ad indicare che ora la soluzione è basica).
Ora, aggiungere NaCl solido finché la soluzione è satura. Non appena satura, decantare il liquido in un imbuto separatore.
Estrarre con 5mL di cloruro di metilene e tenere da parte la fase organica quindi estrarre la fase acquosa con ancora un'aliquota di 5mL di cloruro di metilene.
ATTENZIONE! A causa della volatilità del cloruro di metilene, la pressione può rapidamente crescere all'interno dell'imbuto se la fase acquosa è tipieda. Siate sicuri di sfiatare l'imbuto spesso durante l'estrazione, ma soprattutto fare tutto ciò sotto cappa!
Combinare le fasi organica ed anidrificarle su sodio solfato anidro. Decantare o filtrare per rimuovere l'agente disidratante, e quindi rimuovere il solvente dalla soluzione tramite vuoto, fin quando non ci sarà più formazione di bollicine. Eventualmente scaldare leggermente a 35-40 °C. L'alternativa, in mancanza di vuoto, è quella di lasciar evaporare il solvente per una notte, in luogo ventilato e asciutto.
I seguenti utenti ringraziano quimico per questo messaggio: jobba, fosgene
 Iniziano dal numero 2.
Il riferimento 13 non esiste nell'articolo
Iniziano dal numero 2.
Il riferimento 13 non esiste nell'articolo 


