quimico
2012-04-30 12:16
La scoperta dell'argon è attribuita a Lord Rayleigh e William Ramsay, che la annunciarono nel 1894 e non fornirono ulteriori dettagli fino all'anno successivo. Così facendo si candidarono a partecipare alla competizione organizzata dallo Smithsonian Institution di Washington DC, per "una nuova... scoperta circa l'aria atmosferica". I due vinsero il premio di 10000 dollari (equivalenti a 150000 dollari odierni).
L'argon in realtà era stato scoperto per caso da Henry Cavendish a Clapham, South London, nel 1785 (lo stesso Henry Cavendish che nel 1774 dimostrò che si trattava di un composto di ossigeno ed idrogeno). Lo scienziato si interessava di chimica dell'atmosfera e conduceva esperimenti in cui faceva passare una scintilla elettrica attraverso un miscuglio di aria e ossigeno, e assorbiva i gas che si formavano. Ma, per quanto a lungo facesse attraversare l'aria dalla scarica elettrica, restava sempre un 1% del suo volume che non si combinava chimicamente con altre sostanze. Cavendish non si rese conto di aver trovato un nuovo elemento gassoso  e per oltre un secolo le sue osservazioni rimasero inspiegate. Ma non furono dimenticate.
e per oltre un secolo le sue osservazioni rimasero inspiegate. Ma non furono dimenticate.
Lo stimolo alla riscoperta dell'argon provenne dal misterioso comportamento dell'azoto: come mai la densità di questo gas cambiava a seconda della fonte di provenienza? L'azoto estratto dall'aria aveva una densità di 1.257 grammi per litro, mentre quello ricavato per decomposizione dell'ammoniaca gassosa aveva una densità di 1.251 grammi per litro. Rayleigh e Ramsay si rendevano conto che le possibilità erano due: o l'azoto atmosferico doveva contenere un gas più pesante, o l'azoto di origine chimica doveva contenerne uno più leggero. Quest'ultima spiegazione era estremamente inverosimile, quindi gli studiosi concentrarono le attenzioni sull'azoto di origine atmosferica.
Ramsay fece passare un campione di azoto atmosferico, ritenuto puro, su magnesio scaldato, con il quale reagisce formando un solido, il nitruro di magnesio. Come Cavendish, Ramsay si ritrovò con un residuo pari a circa l'1% del volume iniziale, che non aveva reagito. Questo gas era del 300% più denso dell'idrogeno. Quando ne esaminarono lo spettro atomico, gli studiosi osservarono linee nuove che si potevano spiegare solo come manifestazione di un nuovo elemento.
Idrogeno

Azoto

Ossigeno

Argon

Per dare un nome a questo gas inerte presero spunto dal termine greco argos, che significa "inattivo", e lo chiamarono argon. Ramsay vinse il Premio Nobel per la chimica nel 1904.
L'argon costituisce l'1% dell'atmosfera ed è oggi un importante gas industriale, che si estrae dall'aria liquida in centinaia di stabilimenti in tutti il mondo. Un impianto tipico lavora quotidianamente 375 tonnellate d'aria ed è controllato da un computer, con il solo ausilio di qualche tecnico. L'aria viene separata in azoto, ossigeno e argon, che sono poi trasportati come liquidi in autocisterne da 20 tonnellate.
L'argon è particolarmente importante per l'industria dei metalli. Nella lavorazione dell'acciaio serve come gas inerte per rimescolare il ferro fuso, attraverso il quale viene fatto gorgogliare insieme all'ossigeno, che serve invece a modificarne il contenuto in carbonio. L'argon trova impiego anche quando è necessario eliminare l'aria per impedire l'ossidazione dei metalli ad alta temperatura, come nella lavorazione dell'alluminio fuso. Per poter saldare questo metallo bisogna proteggerlo dall'ossigeno atmosferico. Allo scopo si può usare una saldatrice ad arco che, mediante una corrente continua, crea una scintilla che fonde il metallo per la saldatura. Questo è circondato da un flusso di argon e un tipico apparato di saldatura consuma dai 10 ai 20 litri di argon gassoso al minuto. Gli scienziati atomici proteggono con argon gli elementi di combustibile nelle fasi di purificazione e rigenerazione.
Le leghe per strumenti di alta qualità richiedono polveri metalliche ultrapure, che si producono dirigendo un getto di argon liquido, a -190 °C, su un getto di metallo fuso. Alcune saldatrici, per prevenire la dispersione nell'ambiente di polveri di metalli tossici, li perforano con un cannello a plasma di argon. In questro strumento gli atomi di argon sono caricati elettricamente fino a raggiungere temperature di 10000 °C, che riducono le particelle di polvere ad un grumo di residui fusi.
I chirurghi si servono di laser ad argon per gli interventi sulle arterie e per distruggere i tumori. Il loro intenso fascio di luce blu serve anche ai chimici per rivelare stati molecolari che esistono solo per un millesimo di miliardesimo di secondo.
Alcuni prodotti di consumo contengono argon. Questo gas riempie l'intercapedine che separa i doppi vetri, consentendo un migliore isolamento poiché è un conduttore termico peggiore dell'aria. È argon anche il gas contenuto nei tubi fluorescenti e nelle lampadine ad incandescenza, nelle quali dissipa il calore del filamento incandescente senza reagire con esso. Le insegne luminose brillano di blu se contengono argon, e di celeste se vi è stato aggiunto un po' di vapore di mercurio.

L'uso più inconsueto dell'argon è nei pneumatici delle automobili di lusso, dove non solo protegge la gomma dall'attacco dell'ossigeno, ma rende la ruota meno rumorosa quando l'auto corre.
Molti di questi impieghi dell'argon si avvalgono della sua inerzia chimica: niente può indurlo a reagire con altri materiali, per quanto alta sia la temperatura a cui lo si scalda o per quanto forte la carica elettrica che lo attraversa. Finora ha resistito a tutti i tentativi di farlo legare ad altri atomi: il gas di argon è formato esclusivamente da singoli atomi di argon. Anche i composti che contengono questo elemento, i cosiddeti clatrati di argon, loi includono solo sotto forma di atomi isolati, intrappolati nelle cavità di un reticolo formato da una molecola più grande.
L'atmosfera contiene migliaia di miliardi di tonnellate di argon, accumulatosi lentamente nel corso di miliardi di anni. La maggior parte si è formato dal potassio, che ha un isotopo radioattivo, il 40K, con un tempo di dimezzamento di 1.28 miliardi di anni. Su un milione di atomi di potassio solo 117 sono di questo isotopo. Quando un atomo di 40K decade, il nucleo può emettere una particella β− (oltre ad un antineutrino) trasformandosi in 40Ca, oppure può catturare uno dei suoi elettroni e trasformarsi in 40Ar.
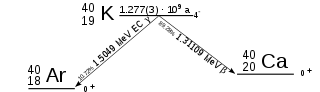
Solo un atomo su dieci prende questa seconda strada, ma data l'età della Terra, pari a 4.6 miliardi di anni, c'è stato tempo sufficiente perché si trasformasse tutto l'argon oggi esistente. Questa spiega anche come mai il peso atomico dell'argon (l'elemento numero 18) sia maggiore di quello del potassio (l'elemento numero 19): la maggior parte dell'argon è 40Ar (peso atomico 39.948 ovvero circa 40), mentre la maggior parte del potassio è 39K (peso atomico 39.0983 ovvero circa 39).
Se il 40K radioattivo è disciolto nel mare o disperso nel suolo, o se fa parte di un organismo, l'argon che da esso si forma si libera nell'atmosfera. Se però il potassio è intrappolato nelle rocce, anche l'argon vi resta intrappolato. Misurando il rapporto tra 40K e 40Ar in un minerale è possibile quindi datarlo.
L'argon appartiene a un gruppo di elementi detti gas nobili, la maggior parte dei quali furono scoperti tra il 1895 e il 1898 da Ramsay e Morris Travers. Tre furono estratti dall'aria: neon, kripton e xenon, che devono i loro nomi ai termini greci neos (nuovo), krypton (nascosto) e xenos (estraneo). Un quarto elemento, l'elio, è stato un altro caso di riscoperta.
Questo gas, il più leggero dei gas nobili, era stati scoperto 30 anni prima da Pierre Janssen quando si era recato in India a studiare un'eclissi totale. Janssen registrò una riga gialla dello spettro solare che non riuscì a spiegare, ma che indicava la presenza di un elemento sconosciuto. L'astronomo Sir Norman Lockyer lo chiamò elio dal greco helios (Sole), e ipotizzò che non potesse esistere sulla Terra. Ramsay lo trovò nel 1895, estraendolo non dall'aria, dove pure è più abbondante del kripton e dello xenon, ma da un minerale di uranio che quando si scioglieva in un acido emetteva bolle di elio (le particelle α, emesse dagli atomi radioattivi, non sono altro che nuclei di elio; non appena è stata emessa, una particella α si lega immediatamente a due elettroni e forma un atomi di elio gassoso).
I seguenti utenti ringraziano quimico per questo messaggio: Max Fritz, Rusty, Enotria, GabriChan, jobba
 Sarebbe bello sapere quale minerale fosse... Ora cerco. O magari qualcuno qui lo sa e ce lo potrebbe gentilmente dire
Sarebbe bello sapere quale minerale fosse... Ora cerco. O magari qualcuno qui lo sa e ce lo potrebbe gentilmente dire 