'Notte ragazzi 
Ho voluto provare a sintetizzare un poco di acetato di rame(II), avendo a disposizione:
Acido acetico glaciale
Solfato di rame (II) pentaidrato
Idrossido di sodio puro in scaglie
Ho proceduto secondo una mia metodica, che si rivelerà sbagliata... a quanto pare 
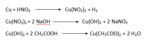
Ho dapprima sintetizzato del Cu(OH)2 usando 125g di CuSO4 5H2O e 40g di NaOH entrambe in soluzione acquosa, li ho uniti a formare un precipitato molto denso di colore blu molto scuro / verdastro. Ho successivamente filtrato questo precipitato (presumibilmente Cu(OH)2 ) e lavato un paio di volte con acqua corrente.
Ho eseguito un rapido test prendendo un po' di idrossido e scaldandolo in un altro beacker, sincerandomi che desse CuO + H2O, come effettivamente è avvenuto, per essere sicuro di aver ottenuto idrossido rameico (si è trasformato tutto in ossido molto in fretta, a meno di 100 °C). Questo CuO è stato poi messo da parte per usarlo in futuro in altre reazioni.
Ottenuto il Cu(OH)2 ho preparato una soluzione di acido acetico glaciale e sciolto all'interno pian piano l'idrossido rameico, questo si è sciolto istantaneamente, e dapprima la soluzione appariva di un bel verde... man mano che aggiungevo l'idrossido rameico ho notato un intorbidimento della soluzione che è diventata sempre più densa e scura.. fin quasi a diventare verde/bluastra. Ho notato che qualcosa cominciava a precipitare, dunque ho rifiltrato per ottenere la soluzione di Cu(CH3COO)2 pronta da evaporare, ma sorpresa! Il filtrato è blù intenso, identico in tutto e per tutto (almeno sembra) ad una soluzione di CuSO4 pentaidrato, e nel filtro è rimasta poca polvere insoluta, di colore verde. Ora mi chiedo, non dovrebbe essere verde(verdone) la soluzione di acetato di rame? Quello che è rimasto nel filtro sembra invece essere proprio acetato di rame in polvere... ma questo sarebbe veramente troppo poco. Specifico che le quantità di Cu(OH)2 e CH3COOH sono state aggiunte stechiometricamente secondo:
Cu(OH)2 + 2 CH3COOH -> Cu(CH3COO)2 + 2 H2O
Come è possibile? Dev'essere il procedimento sbagliato, perchè ho rispettato sempre la stechiometria dall'inizio alla fine. Cosa diavolo ho ottenuto nella soluzione finale e cosa è rimasto nel filtro secondo voi?
Seguono delle foto in ordine cronologico dell'evento infausto 
Grazie a tutti.
CuSO4 5H2O e NaOH

rispettive soluzioni acquose

risultato dell'unione, Cu(OH)2

prova del CuO mentre al centro sto filtrando Cu(OH)2 dal becker di destra

test CuO in dettaglio

polvere rimasta dalla filtrazione della soluzione di Cu(CH3COO)2

colore del filtrato della soluzione di Cu(CH3COO)2

foto d'insieme dall'alto.. che schifezza 

La supposizione che la sintesi sia andata male mi viene guardando la foto su wiki.en dei cristalli di acetato rameico, che appaiono verdi. Ora io non ho ancora evaporato la mia soluzione, e non vedo come possano venir fuori cristalli verde scuro da una soluzione blu/azzurra come la mia 
Dico questo perchè non so che colore debba avere una soluzione più o meno concentrata di acetato di rame (II).
Da wiki.en

Beefcotto87
2010-12-03 10:02
Ti conviene rimettere le foto, non si vedono  Io ne ho ottenuto pochissimo col caro e vecchio metodo dei vapori di acido acetico in un barattolo chiuso + lamina di rame
Io ne ho ottenuto pochissimo col caro e vecchio metodo dei vapori di acido acetico in un barattolo chiuso + lamina di rame 
Da me si vedono perfettamente  p.s. potevo anche usare la solita miscela H2O2 + AcOH + Cu, ma ho voluto variare... altrimenti mi annoio
p.s. potevo anche usare la solita miscela H2O2 + AcOH + Cu, ma ho voluto variare... altrimenti mi annoio 
Max Fritz
2010-12-03 13:11
Rusty, mi sa che sei un po' daltonico...  Vedi verde la foto di wiki? Il tuo prodotto (nel filtro) mi sembra del tutto simile a quello dell'ultima foto (tranne la forma cristallina...). Se hai rispettato la stechiometria dovresti aver evitato un eccesso di NaOH o anche uno di Cu(OH)2 mi auguro, poichè di sicuro il primo avrebbe fatto riprecipitare un po' di idrossido, il secondo in eccesso non si sarebbe sciolto. Per il resto non sarei così sicuro che il colore della sostanza solida debba essere del tutto uguale a quello della soluzione, e direi che è il caso di procedere a cristallizzare e determinare solo alla fine se la reazione ha funzionato o meno
Vedi verde la foto di wiki? Il tuo prodotto (nel filtro) mi sembra del tutto simile a quello dell'ultima foto (tranne la forma cristallina...). Se hai rispettato la stechiometria dovresti aver evitato un eccesso di NaOH o anche uno di Cu(OH)2 mi auguro, poichè di sicuro il primo avrebbe fatto riprecipitare un po' di idrossido, il secondo in eccesso non si sarebbe sciolto. Per il resto non sarei così sicuro che il colore della sostanza solida debba essere del tutto uguale a quello della soluzione, e direi che è il caso di procedere a cristallizzare e determinare solo alla fine se la reazione ha funzionato o meno 
arkypita
2010-12-03 14:09
Max Fritz ha scritto:
Rusty, mi sa che sei un po' daltonico...  Vedi verde la foto di wiki?
Vedi verde la foto di wiki?
ATTENZIONE: quando si parla di "colore che vedo io e colore che vedi tu" bisogna sempre tenere presente che i colori di una immagine possono variare anche molto in base al monitor che la visualizza (oltre che dalle sue impostazioni). Io che ho un dual-monitor questa cosa la noto tantissimo!
In un discorso più generale la percezione dei colori può essere falsata anche dalla luce ambientale e dalla percezione del singolo individuo.
Da questa forse banale osservazione dobbiamo dedurre che non si può fare troppo affidamento al colore come discriminante dei nostri risultati!
Max Fritz
2010-12-03 15:05
Wow... non sapevo il fatto dei monitor. Comunque in generale è vero, fare affidamento sul colore può portare a grossi sbagli. Per quello dicevo di far cristallizzare comunque.
Ok grazie ragazzi, procedo in ogni caso alla cristallizzazione... vediamo cosa ne viene fuori. La stechiometria l'ho rispettata al massimo delle mie possibilità / strumenti, oltre al colore, che come dice giustamente arkypita può variare dal gamma del monitor, io mi baso anche sulla descrizione che ne danno a proposito del colore... mah, vediamo comunque.
Nel caso stanotte o domani mattina posto il risultato, e se è davvero acetato rameico tolgo il "FALLITO" dal titolo del thread 
Sta cosa del colore della soluzione vs colore del sale disciolto me la devo sfatare... in effetti potrebbe significare poco 
Grazie ancora 
al-ham-bic
2010-12-03 21:00
Il colore azzurro del diidrato è giusto.
Se hai fatto tutto stechiometricamente (come credo), attento che l'acetato di rame è molto solubile ma non solubilissimo.
Se ne hai in soluzione più di una dozzina di g/100 ml (ho fatto una media con le T°) ti precipita.
Quindi fai la sol. satura (tutto deve scogliersi perfettamente, no residui sul filtro!) e lascia evaporare lentamente: viene bene di sicuro.
(mi sembra banale aggiungere che se quel residuo sul filtro non deriva da sol. satura e non è solubile, non è acetato...)
Dott.MorenoZolghetti
2010-12-03 21:43
Aggiungerei che, salvo poche eccezioni, i sali di rame (II) idrati sono BLU (o azzurri) e MAI verdi. Verdi sono i sali di nichel (II).
Dott.MorenoZolghetti ha scritto:
salvo poche eccezioni...
...MAI verdi.
o mai o salvo poche eccezioni  comunque uno verde tanto per fare sapere che lo so è il cloruro...
comunque uno verde tanto per fare sapere che lo so è il cloruro...
Grazie a tutti per i chiarimenti. In effetti mi stavo fasciando la testa prima di rompermela, perchè ho evaporato parte della soluzione e messa fuori tutta la notte. C'erano 2 °C quindi condizioni ideali per cristallizzare velocemente  In effetti la soluzione in evaporazione era verde scuro, molto scuro forse perchè molto concentrata, ma non bluastra (la foto non rende... forse devo impostare qualcosa sulla macchina digitale... boh).
Al, quello che vedevo nel filtro era proprio un eccesso di acetato, infatti l'ho lavato completamente con acqua e si è disciolto perfettamente.
Vi mostro la soluzione all'ebollizione (non guardate il contesto, so che non è un home lab come i vostri, per ora mi devo arrangiare
In effetti la soluzione in evaporazione era verde scuro, molto scuro forse perchè molto concentrata, ma non bluastra (la foto non rende... forse devo impostare qualcosa sulla macchina digitale... boh).
Al, quello che vedevo nel filtro era proprio un eccesso di acetato, infatti l'ho lavato completamente con acqua e si è disciolto perfettamente.
Vi mostro la soluzione all'ebollizione (non guardate il contesto, so che non è un home lab come i vostri, per ora mi devo arrangiare  ) e qualche cristallino estratto dalla soluzione stamattina quando sono andato a vedere il risultato. Ho messo di fianco ai cristallini un oggetto blu (nella fattispecie è un elettromagnete, by the way... ) per capire la differenza, seppur non netta, di colore. Anche la forma cristallina nella quale sta cristallizzando è diversa dal CuSO4*5H2O, e questo assieme al fatto del colore verde scuro/blu (dal vivo è un'altra cosa, non riesco a descriverlo completamente, ma NON è blu), mi rassicura sul fatto siano probabilmente cristalli di Cu(AcOH)2.
Grazie a tutti per i consigli, alla prossima sintesi! (ora mi butto sul nichel e sul cromo.. che colori!)
) e qualche cristallino estratto dalla soluzione stamattina quando sono andato a vedere il risultato. Ho messo di fianco ai cristallini un oggetto blu (nella fattispecie è un elettromagnete, by the way... ) per capire la differenza, seppur non netta, di colore. Anche la forma cristallina nella quale sta cristallizzando è diversa dal CuSO4*5H2O, e questo assieme al fatto del colore verde scuro/blu (dal vivo è un'altra cosa, non riesco a descriverlo completamente, ma NON è blu), mi rassicura sul fatto siano probabilmente cristalli di Cu(AcOH)2.
Grazie a tutti per i consigli, alla prossima sintesi! (ora mi butto sul nichel e sul cromo.. che colori!)


I seguenti utenti ringraziano Rusty per questo messaggio: **R@dIo@TtIvO**
**R@dIo@TtIvO**
2010-12-04 09:44
Hai visto infine ci sei riuscito!  Sembra acetato di rame noto qualche sfumatura verde nei tuoi cristalli!
Sembra acetato di rame noto qualche sfumatura verde nei tuoi cristalli! 
al-ham-bic
2010-12-04 13:47
quimico ha scritto:
...mi serviva per farci un acetiluro di rame(I)... e appena si gocciola l'alchino in etanolo si inizia a formare un precipitato...
Parli di un "alchino in etanolo" su rame ridotto con idrossilamina; forse non era strettamente un acetiluro ma un "alchinuro", passami il nome!
Che alchino era? Mi sono sempre simpaticissime le sostanze con un sigma e due pigreco  Rusty, scusa l'OT...
Rusty, scusa l'OT...
no no al è un acetiluro e non lo dico io ma i sacri testi. comunque anche il nome da te proposto ci sta  è l'1-(1-etossietil)-1H-pirazol-4-il-etinil) rame(I)
è l'1-(1-etossietil)-1H-pirazol-4-il-etinil) rame(I)
Riprendo qua la mia personale lotta contro i colori dei sali in soluzione vs colori dei sali cristallizzati. Sto ricristallizzando l'acetato che avevo ottenuto, ed in effetti in questa foto si nota per bene la differenza di colore tra il sale che sta cristallizzando (verdone) e la soluzione (azzurra).
La sintesi poi è stata fatta bene anche da R@d quindi questo non aggiunge nulla di nuovo, ma era tanto per aggiungere un'altra foto che non fa' mai male 

I seguenti utenti ringraziano Rusty per questo messaggio: **R@dIo@TtIvO**
I seguenti utenti ringraziano zodd01 per questo messaggio: ClaudioG., ohilà














 Io ne ho ottenuto pochissimo col caro e vecchio metodo dei vapori di acido acetico in un barattolo chiuso + lamina di rame
Io ne ho ottenuto pochissimo col caro e vecchio metodo dei vapori di acido acetico in un barattolo chiuso + lamina di rame 
 Vedi verde la foto di wiki? Il tuo prodotto (nel filtro) mi sembra del tutto simile a quello dell'ultima foto (tranne la forma cristallina...). Se hai rispettato la stechiometria dovresti aver evitato un eccesso di NaOH o anche uno di Cu(OH)2 mi auguro, poichè di sicuro il primo avrebbe fatto riprecipitare un po' di idrossido, il secondo in eccesso non si sarebbe sciolto. Per il resto non sarei così sicuro che il colore della sostanza solida debba essere del tutto uguale a quello della soluzione, e direi che è il caso di procedere a cristallizzare e determinare solo alla fine se la reazione ha funzionato o meno
Vedi verde la foto di wiki? Il tuo prodotto (nel filtro) mi sembra del tutto simile a quello dell'ultima foto (tranne la forma cristallina...). Se hai rispettato la stechiometria dovresti aver evitato un eccesso di NaOH o anche uno di Cu(OH)2 mi auguro, poichè di sicuro il primo avrebbe fatto riprecipitare un po' di idrossido, il secondo in eccesso non si sarebbe sciolto. Per il resto non sarei così sicuro che il colore della sostanza solida debba essere del tutto uguale a quello della soluzione, e direi che è il caso di procedere a cristallizzare e determinare solo alla fine se la reazione ha funzionato o meno 
 ) e qualche cristallino estratto dalla soluzione stamattina quando sono andato a vedere il risultato. Ho messo di fianco ai cristallini un oggetto blu (nella fattispecie è un elettromagnete, by the way... ) per capire la differenza, seppur non netta, di colore. Anche la forma cristallina nella quale sta cristallizzando è diversa dal CuSO4*5H2O, e questo assieme al fatto del colore verde scuro/blu (dal vivo è un'altra cosa, non riesco a descriverlo completamente, ma NON è blu), mi rassicura sul fatto siano probabilmente cristalli di Cu(AcOH)2.
Grazie a tutti per i consigli, alla prossima sintesi! (ora mi butto sul nichel e sul cromo.. che colori!)
) e qualche cristallino estratto dalla soluzione stamattina quando sono andato a vedere il risultato. Ho messo di fianco ai cristallini un oggetto blu (nella fattispecie è un elettromagnete, by the way... ) per capire la differenza, seppur non netta, di colore. Anche la forma cristallina nella quale sta cristallizzando è diversa dal CuSO4*5H2O, e questo assieme al fatto del colore verde scuro/blu (dal vivo è un'altra cosa, non riesco a descriverlo completamente, ma NON è blu), mi rassicura sul fatto siano probabilmente cristalli di Cu(AcOH)2.
Grazie a tutti per i consigli, alla prossima sintesi! (ora mi butto sul nichel e sul cromo.. che colori!)


 dai càzzo! alla fine ho rubato i 400mg all'altro laboratorio... era quasi anidro. come ben saprete il rame(II) solfato anidro è bianco... quello era azzurrino ergo era 1po' bagnato causa umidità... va beh. grazie... altrettanto.
dai càzzo! alla fine ho rubato i 400mg all'altro laboratorio... era quasi anidro. come ben saprete il rame(II) solfato anidro è bianco... quello era azzurrino ergo era 1po' bagnato causa umidità... va beh. grazie... altrettanto.