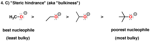Come saprai, un nucleofilo è una specie che, nell'accezione di Lewis dona una coppia di elettroni per formare un nuovo legame covalente. La nucleofilicità è misurata comparando le velocità di reazione; più veloce la reazione, migliore (o, "più forte" il nucleofilo.
il nucleofilo.
Quando si discute la nucleofilicità stiamo parlando specificatamente della donazione di una coppia di elettroni ad un atomo diverso da idrogeno (di solito un atomo di carbonio). Quando una specie sta donando una coppia di elettroni ad un atomo di idrogeno (più specificamente, un protone, H+) la chiamiamo una base.
Questo post tratta un argomento base della Chimica Organica. Per un discorso più approfondito ci sono i libri. Ok? Anche perché sono cose che non dovrei dirti io... Ma va beh.
Allora, quali sono i fattori che rendono un nucleofilo buono?
Per i nostri scopi, ci sono almeno 4 fattori chiave che contribuiscono alla nucleofilicità.
1. Carica
2. Elettronegatività
3. Solvente
4. Ingombro sterico
The first two should hopefully be familiar from the discussion of what makes something a strong base. After all, basicity and nucleophilicity essentially describe the same phenomenon, except basicity concerns donation of lone pairs to hydrogen, and nucleophilicity concerns donations of lone pairs to all other atoms. It’s the third and fourth points where extra factors come into play.
1. Il ruolo della carica
Dato che il nucleofilo è una secie che sta per donare una coppia di elettroni, è ragionevole aspettarsi che la sua abilità di donare elettroni aumenterà quando diventerà più elettron-ricco, e diminuirà quando esso diventerà più elettron-povero, giusto? Così come la densità elettronica aumenta, lo fa anche la nucloefilicità.
Una regola pratica per ricordarsi questa cosa è la seguente: la base coniugata è sempre un nucleofilo migliore.
2. Elettronegatività
Assumendo che un atomo abbia una coppia di elettroni da donare, l'abilità di una specie di donare quella coppia dovrebbe essere inversamente proporzionale a quanto "strettamente legata" essa sia. Il fattore chiave per determinare quanto sia "strettamente legata" una coppia elettronica è legato al famigliare concetto di elettronegatività.
All'aumentare dell'elettronegatività, la nucleofilicità diminuisce. Nota: È importante restringere l'applicazione di questo comportamento ad atomi nella stessa riga della tavola periodica; per esempio, C N O F, o Si P S Cl. Scendendo lunga la tavola periodica, anche un altro fattore gioca un ruolo base.
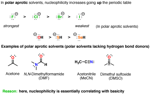
3. Solvente
La nucleofilicità non è una proprietà inerente ad una data specieì; può essere influenzata dal mezzo in cui si trova (altresì noto come “il solvente”).
Un solvente polare protico può partecipare nel legame ad idrogeno con un nucleofilo, creando un "guscio"di molecole di solvente attorno ad esso. Nel fare ciò, il nucleofilo è considerevolmente meno reattivo; ovunque esso vada, la sua coppia di elettroni non condivisi interagisce con gli atomi di idrogeno elettron-poveri del solvente.
L'abilità di un nucleofilo di partecipare nel legame ad idrogeno diminuisce non appena noi scendiamo lungo la tavola periodica. Perciò il fluoruro è il più forte accettore di legame ad idrogeno, e lo ioduro è il più debole. Questo significa che la coppie elettroniche non condivise dello ione ioduro saranno considerevolmente più "libere" di quelle del fluoruro, portando a rese più elevate (e maggiore nucleofilicità).
Un solvente polare aprotico non fa legami ad idrogeno con i nucleofili in modo significativo, e questo vuol dire che i nucleofili hanno maggiore libertà in soluzione. Sotto queste condizioni, la nucleofilicità si correla bene con la basicità – e lo ione fluoruro, essendo il più instabile degli ioni alogenuro, reagirà più velocemente coi nucleofili.
[Ti sarai forse chiesta: perché non trattiamo i “solventi non polari” qui? Ricordi “il simile scioglie il simile”? Se vogliamo che una reazione prenda luogo, necessitiamo di usare solventi che sciolgono davvero il nostro nucleofilo. Molti nucleofili sono specie cariche ("ioni" – essi non si sciolgono in solventi non polari.]
– essi non si sciolgono in solventi non polari.]
4. Ingombro sterico
Poiché, quando stiamo discutendo la nucleofilicità, stiamo spesso discutendo delle reazioni all'atomo di carbonio, dobbiamo prendere in considerazione che gli orbitali all'atomo di carbonio che partecipano alla reazioni sono generalmente meno accessibili rispetto a quanto i protoni lo siano. Un effetto chiamato "ingombro sterico" gioca anche esso un ruolo base.
Più ingombrante un dato nucleofilo è, minore la velocità delle sue reazioni [e quindi minore la sua nucleofilicità].
Così comparando diversi alcoli deprotonati, nella sequenza metanolo – etanolo – isopropanolo – t-butanolo, il metanolo deprotonato (“metossido”) è il nucleofilo più forte, ed il t-butanolo deprotonato (“t-butossido”) è il più povero (o “più debole”) nucleofilo.
Esistono altri fattori? Sì. Esistono anche altri fattori da non tralasciare. 1) La natura dell'elettrofilo 2) gli atomi con doppietti non condivisi adiacenti al nucleofilo 3) nel caso di ioni, la natura del contro-ione [specie positivamente cariche] possono essere significativi.
http://sites.uci.edu/chem51a/files/2014/09/NucleophileStrength.pdf
 oppure molte volte non so scegliere tra E1 o SN1 oppure tra E2 o SN2, ci sono degli accorgimenti?
Grazie mille in anticipo a chi mi aiuterà
oppure molte volte non so scegliere tra E1 o SN1 oppure tra E2 o SN2, ci sono degli accorgimenti?
Grazie mille in anticipo a chi mi aiuterà 

 il nucleofilo.
il nucleofilo.