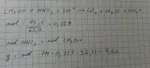DarkSide
2017-02-09 13:28
Scusate, non mi torna il risultato di questo esercizio. Cosa ho sbagliato?
A temperatura e pressione elevate il metanolo viene ossidato dall’ acido nitrico. Bilanciare la reazione utilizzando il metodo ionico-elettronico
CH3OH(aq)+ NO3-(aq)->CO2(g) + NH4+(aq)
Riportare la reazione anche in forma molecolare e calcolare quanti chilogrammi di metanolo vengono ossidati da 14.5 kg di HNO3 . (Risp. 4.92 kg)
Grazie
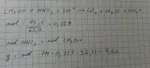 WhatsApp Image 2017-02-09 at 14.25.20.jpeg
WhatsApp Image 2017-02-09 at 14.25.20.jpeg
Hai sbagliato tutto 
a) il numero di ossidazione del C nel CH3OH è -2 e si ossida a +4 nella CO2;
b) il numero di ossidazione dell'N nell'NO3- è +5 e si riduce a -3 nell'NH4+;
c) per calcolare il numero di moli la massa deve essere espressa in g;
d) la MM dell'HNO3 è 63,01 g/mol
e) la MM del CH3OH è 32,04 g/mol
Il risultato indicato è corretto: 4,92 kg di CH3OH.
I seguenti utenti ringraziano LuiCap per questo messaggio: DarkSide