quimico
2011-12-08 18:12
La riduzione di alchini ed anelli benzenici tramite soluzioni di sodio o litio in ammoniaca liquida sono ben note (magari prossimamente farò un topic sugli alchini). Altri metalli reattivi, come zinco e magnesio hanno giocato un ruolo nelle riduzioni di aldeidi e chetoni (riduzione di Clemmensen), alogenuri alchilici e dialogenuri vicinali. L'abilità di certi metalli di donare elettroni a (ridurre) gruppi funzionali elettrofili o insaturi si è dimostrata utile in diverse procedure di riduzione. La facilità con cui diversi di questi metalli donano elettroni è data dai loro potenziali di riduzione. Da questi potenziali l'ordine qualitativo del potere riducente è:
Li > K > Na > Mg > Al = Ti > Zn > Fe > Sn.
1. Riduzioni di gruppi carbonilici isolati
Litio, sodio e potassio riducono i chetoni tramite trasferimento di un elettrone che genera un radical anione noto come chetile. Una volta che tale specie reattiva si è formata, essa può reagire successivamente tramite diversi modi, come descritto nello schema seguente. Se una specie protonica è presente, il chetile subisce protonazione del carbonio, e il risultante ossi radicale addiziona un altro elettrone generando un sale alcossido. Alternativamente, i chetili possono dimerizzare a sali pinacolici. L'isolamento dei prodotti, alcole o pinacolo, richiede la successiva protonazione tramite acidi forti almeno quanto l'acqua o l'etanolo. La notazione H+ si riferisce ad una delle diverse fonti possibili di protone, includendo ammoniaca, alcoli ed il catione ammonio (un acido forte nel sistema ammoniaca liquida). Il benzofenone (difenil chetone) forma un chetile blu scuro che è stabile in solventi che non hanno idrogeni acidi, quali gli idrocarburi e gli eteri. È diffusamente usato come indicatore di impurità ossidanti o acidi durante la purificazione di tali solventi.
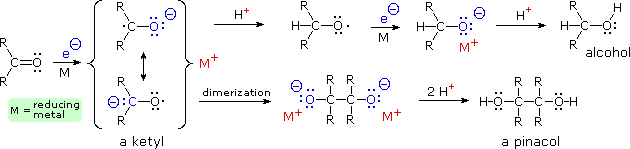
I solventi usati per la riduzioni con metalli alcalini includono idrocarburi, eteri e, più comunemente, ammoniaca liquida. Possono anche essere usati gli alcoli, ma di solito come co-solventi, poiché essi reagiscono vigorosamente con questi metalli. Esempi di riduzioni con metalli di chetoni ad alcoli e pinacoli sono mostrate sotto.
Nel primo esempio, la riduzione del benzofenone in ammoniaca liquida porta ad entrambi i prodotti, alcole e pinacolo. L'intermedio chetile in questa reazione è stabilizzato dai sostituenti fenile, e le competitive protonazione dell'atomo di carbonio e dimerizzazione generano sali alcossido che rimangono in soluzione fino a quando vengono idrolizzati prima dell'isolamento del prodotto.
Nella seconda reazione, le due funzioni chetoniche isolate sono ridotte ad alcoli. Gli intermedi chetile non sono stabilizzati, e la loro rapida protonazione è garantita dal co-solvente alcolico. Il movimento conformazionale è ristretto dalla struttura rigida policiclica carboniosa del substrato, ed è mostrata una interessante stereoselettività: entrambi gli alcoli sono formati come isomero equatoriale.
Le aldeidi non sono di solito ridotte in questo modo, perché esse reagiscono con l'ammoniaca a formare prodotti di condensazioni imminici non reattivi.
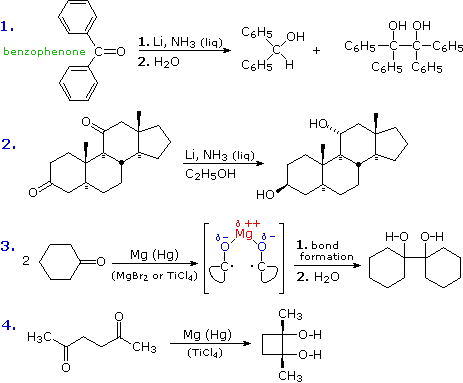
Quando i prodotti pinacolici sono desiderati, viene scelto per la riduzione un metallo meno reattivo avente legami C-O più forti (meno ionici). Di solito viene usato il magnesio, e risultati migliori sono stati ottenuti quando il metallo è attivato tramite amalgamazione (legato al mercurio) ed è presente un acido di Lewis. Le equazioni #3 & 4 (sopra) illustrano la riduzione pinacolica. Un catione di-positivo può servire a mantenere due metà chetile associate vicine l'una all'altra così che il legame venga facilitato (come mostrato nell'equazione #3). L'idrolisi dell'alcossido metallico rilascia il prodotto.
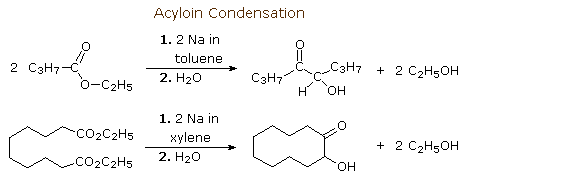
Gli esteri subiscono riduzione per trattamento con sodio. La più utile reazione di questo tipo è la condensazione aciloinica. Per evitare la protonazione al carbonio, questa reazione è normalmente condotta in solventi idrocarburici. La condensazione aciloinica crea alfa-idrossi chetoni. Due esempi di questa reazione sono mostrati qui. Il secondo illustra l'utilità di questa reazione per la costruzione di anelli di medie e grandi dimensioni.
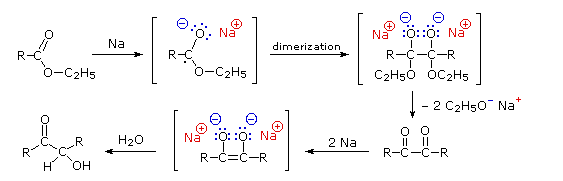
Sotto è mostrato uno schema per un possibile meccanismo per la condensazione aciloinica. La riduzione di alfa-dichetoni ad aciloine, come mostrato nella seconda fila, può essere condotta indipendentemente.
2. Rimozione riduttiva di sostituenti in α
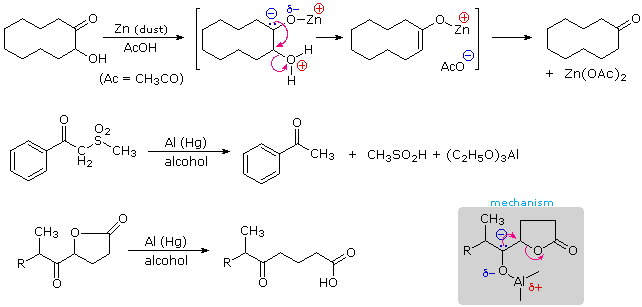
La carica negativa parziale sull'atomo di carbonio di un chetile serve ad eliminare un sostituente elettronegativo in posizione alfa. Se non si desidera la successiva riduzione, alluminio o zinco sono spesso scelti per questa eliminazione riduttiva. Gli esempi seguenti illustrano tre trasformazioni tali, la prima è una utile conversione di aciloine a chetoni.
3. Riduzione di sistemi ad elettroni π coniugati
Due o più gruppi funzionali diversi sono di solito trovati assieme in una molecola, e l'interazione di uno su un altro può portare ad una chimica inaspettata. Le reazioni di addizione di dieni coniugati sono un esempio di questo fenomeno. Una situazione simile avviene negli enoni coniugati, composti in cui un gruppo carbonile è legato ad un doppio legame carbonio-carbonio.
C=C–C=O (an α,β-unsaturated ketone or enone)
Tali combinazioni funzionali sono spesso preparate tramite una condensaziona aldolica, e sono particolarmente utili come intermedi sintetici. Poiché i sistemi ad elettroni π dei due gruppi funzionali sono coniugati (gli orbitali π si sovrappongono nello spazio), il radical anione formato tramite addizione dell'elettrone da un metallo riducente è un ibrido di risonanza di sei strutture canoniche. In aggiunta ai due contributi chetile descritti sopra, due strutture aventi carattare radicale e nucleofilo al carbonio beta sono mostrate nello schema seguente, ed altre due in cui il carattere radical anionico è localizzato sul doppio legame sono probabilmente meno importanti.
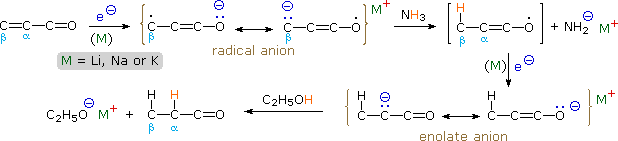
Il destino comune dei chetili estesi descritti qui è la protonazione (o altro legame elettrofilo) all'atomo di carbonio beta. Questo crea un radicale enossi che immediatamente accetta un elettrone per formare un anione enolato. La protonazione o l'alchilazione di questa specie enolato prota quindi ad un chetone saturo, che può essere isolato o ulteriomente ridotto a seconda delle condizioni di reazione. Quattro esempi di tali reazioni sono mostrate sotto.
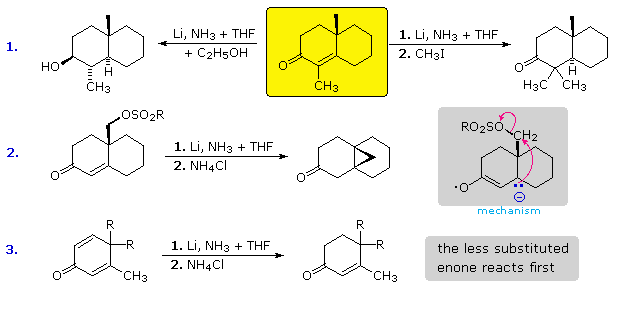
Nell'esempio #1 il substrato enonico è disegnato nel riquadro giallo. Se la riduzione con litio è condotta in ammoniaca liquida senza qualsiasi co-solvente acido, l'anione enolato è stabile e rimane intatto finché un reagente elettrofilo come il metile ioduro viene aggiunto. Questo è mostrato per la reazione a destra. Se un co-solvente acido come l'etanolo è presente, l'anione enolato viene protonato, e il chetone risultante è quindi ridotto ad un alcole (reazione a sinistra). Sebbene il radical anione intemerdio di solito subisca protonazione al carbonio beta, questa non è una reazione veloce in ammoniaca liquida.
L'esempio #2 presenta un interessante caso in cui l'alchilazione intramolecolare del nucleofilo beta avviene più veloce rispetto alla protonazione.
L'esempio #3 è un caso di coniugazione incrociata. Il gruppo carbonile è coniugato con uno o l'altro doppio legame, ma non con entrambi simultaneamente. I due diversi radical anioni possono essere formati tramite addizione di un elettrone, e questi esistono in equilibrio l'uno con l'altro. La protonazione ad un carbonio beta intrappolata effettivamente un radical anione come il suo correlato anione enolato, prevenendo qualsiasi interconversione successiva. Questa protonazione è la più veloce al sito meno sostituito (enone superiore), e se il risultante anione enolato non è convertito nella sua forma chetonica tramite protonazione in situ, non reagirà ulteriomente sino al quenching con lo ione ammonio.
I dieni coniugati sono ridotti anche da sodio o litio in ammoniaca liquida. L'1,3-cicloesadiene viene ridotto a cicloesene, ma l'1,4-diene non coniugato no. Se un doppio legame è coniugato con un anello benzenico, come nello stirene, è ridotto ugualmente.