I seguenti utenti ringraziano EdoB per questo messaggio: fosgene, luigi_67, Beefcotto87, Geber, yennefer, Copper-65
Come è stato lavorare col cloroacetato di metile? È di autosintesi?
Lo ricordo come composto volatile, molto tossico e soprattutto irritante e lacrimogeno...
I seguenti utenti ringraziano fosgene per questo messaggio: EdoB
Si è di autosintesi, ma me lo sono prodotto usando gli scarti della sintesi del cloruro di cloroacetile. Infatti, dopo aver trattato con cloruro di tionile l'acido cloroacetico, ho distillato il cloruro acilico ma nella caldaia mi era rimasto dell'acido non reagito. Così ho deciso di aggiungere un grande eccesso di metanolo, acido solforico e riflussare per diverso tempo. L'ho fatto giusto per minimizzare gli sprechi. Poi mi è tronato utile in questa sintesi quasi per caso. Non è cos'ì tanto volatile (p.e. = 131°), però mi è capitato di sentirne l'odore mentre lo travasavo nella sua bottiglia (erano poi pochi ml) e in effetti non è molto piacevole, la lacrima è scesa diciamo ahahha. La tossicità è assimilabile a quella dell'acido per quanto ne so. In ogni caso è facile limitare l'esposizione al minimo anche senza cappa, almeno fino a che le quantità in gioco sono quelle usate da me.
EdoB ha scritto:
Poi mi è tronato utile in questa sintesi quasi per caso. Non è cos'ì tanto volatile (p.e. = 131°), però mi è capitato di sentirne l'odore mentre lo travasavo nella sua bottiglia (erano poi pochi ml) e in effetti non è molto piacevole, la lacrima è scesa diciamo ahahha.
Di cosa odora?
Altra cosa, il sale di fosfonio per cosa ti serve? Una Witting?
I seguenti utenti ringraziano fosgene per questo messaggio: EdoB
L'odore non è pessimo ma non si può nemmeno definire gradevole sicuramente non dolce o "rassicurante" come quello degli esteri alifatici classici, non ha nulla di simile all'acetato di metile o etile. A me ricorda un po' l'alcool etilico denaturato ma è meno forte. Dopo averlo annusato il naso pizzica un po', è molto meno lacrimogeno del cloruro di benzile, anche se la temperatura di ebollizione è parecchio più bassa. Quanto all'uso: si, lo devo deprotonare con NaOH per ottenere l'ilide. Poi posso farla reagire con aldeidi e chetoni per ottenere i rispettivi esteri etenoici. Ad esempio, facendola reagire con la benzaldeide si ottiene il cinnamato di metile. La cosa peculiare è che le reazioni coinvolte sono molto eco-friendly e soprattutto chemist-friendly  . Niente basi super reattive come idruri o litio alchili, inoltre la reazione si conduce in condizioni neat (senza solvente). Poi si usa una piccola quantità di alcani (esani, eptani, cicloesano, P.E. ecc..) per estrarre il prodotto. Si trova comunque un video da cui o preso spunto sul canale YouTube eku_chem_lab.
. Niente basi super reattive come idruri o litio alchili, inoltre la reazione si conduce in condizioni neat (senza solvente). Poi si usa una piccola quantità di alcani (esani, eptani, cicloesano, P.E. ecc..) per estrarre il prodotto. Si trova comunque un video da cui o preso spunto sul canale YouTube eku_chem_lab.
I seguenti utenti ringraziano EdoB per questo messaggio: fosgene
PS: se ti sintetizzi un alcossido, da utilizzare come base, potresti anche tentare la reazione di Darzen.
Non ci avevo pensato! Grazie dello spunto 
Ho controllato su reaxys.. con l'acetone, che è il primo chetone che mi è venuto in mente, la bella notizia è che la sintesi non richiede reagenti o condizioni troppo esotici. Quella cattiva è che le rese sono bassine (44/55%) ma soprattutto si usa l'etere etilico, che non ho, e il potassio tertbutossido, che non ho. Forse potrei sostituire il dietiletere con il THF, per il potassio tertbutossido con un piccolo sforzo potrei recuperarne ma non so per il momento quanto ne valga la pena. Nel caso prima farò altre ricerche e poi magari provo a usare reagenti alternartivi come appunto il THF, il metilato, etilato o isopropilato di sodio. In ogni caso mi segno questa reazione nelle cose da fare!
Aggiungo un piccolo aggiornamento al post iniziale. Ho ripetuto la sintesi su una scala circa 6 volte maggiore, per lavare il prodotto finale da i possibili reagenti rimasti (in particolare la trifenilfosfina che non è volatile), consiglio di usare toluene al posto dell'eptano o degli alcani in generale. Infatti la trifenilfosfina è più solubile in questo solvente. Gli unici svantaggi sono che è più tossico e che è meno volatile, quindi il solido ottenuto va poi asciugato a pressione ridotta. Non mi sono fidato a lasciarlo asciugare all'aria perché il prodotto assorbe acqua, dopo tutto è un sale! Quindi ho lasciato la miscela di reazione sotto agitazione con del toluene per una notte, ho filtrato, lavato con poco isoesano per rimuovere il grosso del solvente, e poi fatto asciugare a pressione ridotta (pompa ad acqua) scaldando con un asciugacapelli. Ho provato anche a scaldare una piccola quantità in un becher sulla piastra riscaldante. Anche tenendolo a 80 gradi per qualche decina di minuti odora ancora di toluene però. Alzando la temperatura troppo, circa 160-180°C, si brucia producendo un liquido giallo marrone simile al caramello. Se si vuole usare per preparare il reattivo di wittig però, si può anche accettare il fatto che vi siano tracce di toluene, tanto poi la reazione si fa in acqua ed è possibile far bollire la soluzione per eliminare le ultime tracce di solvente prima di condurre la reazione.
I seguenti utenti ringraziano EdoB per questo messaggio: yennefer, Geber
![[Infiammabile]](images/infiammabile.png.pagespeed.ce.Yw0knUm38k.png)
![[Tossico]](images/tossico.png.pagespeed.ce.BU9Uoks0SY.png)
![[Corrosivo]](images/corrosivo.png) Trifenilfosfina
Trifenilfosfina ![[Perocoloso per la salute]](images/salute.png.pagespeed.ce.IsqXXoCLKe.png)
![[Corrosivo]](images/corrosivo.png)
![[Irritante]](images/irritante.png.pagespeed.ce.KZwWJmvAGL.png) Eptano
Eptano ![[Infiammabile]](images/infiammabile.png.pagespeed.ce.Yw0knUm38k.png)
![[Irritante]](images/irritante.png.pagespeed.ce.KZwWJmvAGL.png) Procedimento:
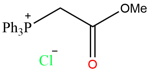
In una provetta in borosilicato ho inserito 1,311 g (5 mmol) di trifenilfosfina e 0,543 g (5 mmol) di cloroacetato di metile.
Procedimento:
In una provetta in borosilicato ho inserito 1,311 g (5 mmol) di trifenilfosfina e 0,543 g (5 mmol) di cloroacetato di metile.






 . Niente basi super reattive come idruri o litio alchili, inoltre la reazione si conduce in condizioni neat (senza solvente). Poi si usa una piccola quantità di alcani (esani, eptani, cicloesano, P.E. ecc..) per estrarre il prodotto. Si trova comunque un video da cui o preso spunto sul canale YouTube eku_chem_lab.
. Niente basi super reattive come idruri o litio alchili, inoltre la reazione si conduce in condizioni neat (senza solvente). Poi si usa una piccola quantità di alcani (esani, eptani, cicloesano, P.E. ecc..) per estrarre il prodotto. Si trova comunque un video da cui o preso spunto sul canale YouTube eku_chem_lab.