Pomodoronda
2013-10-01 19:38
Prima di parlare della reazione in questione farò un piccolo preambolo.
Uno degli esempi più rilevanti di reazione di metatesi in chimica organica è costituito dalla metatesi olefinica.
Tale reazione, catalizzata da complessi di metalli di transizione, è un processo che consiste nella rottura di due doppi legami olefinici appartenenti alla stessa o a due differenti molecole, con il successivo riarrangiamento statistico dei carboni vinilici. Ciò si traduce formalmente in uno scambio dei sostituenti sui due doppi legami (Schema 1).
Schema 1

Esistono vari processi metatetici che vengono largamente impiegati in chimica organica, i quali vengono distinti in base al tipo di legame insaturo coinvolto:
1. Metatesi intermolecolare (CM)
2. Metatesi intramolecolare con chiusura d’anello (RCM)
3. Polimerizzazione tramite apertura metatetica d’anello (ROMP)
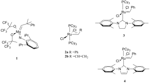
Uno dei problemi fondamentali che limita l’applicazione su vasta scala delle reazioni di metatesi olefinica, è la formazione di sottoprodotti, che devono essere successivamente smaltiti. Una fondamentale evoluzione in questo senso è rappresentata dalla metatesi eninica, una variante metatetica in cui sono coinvolti un alchene e un alchino che riorganizzano le proprie insaturazioni per dare un sistema 1,3-dienico.
La driving force di questo processo è correlata alla natura di diene coniugato del prodotto, che è entalpicamente favorito.
Le tipologie di metatesi eninica possibili ricalcano quelle viste per la metatesi olefinica. Esiste quindi una metatesi eninica intermolecolare (EnYne Cross Metathesis, EYCM) (Schema 2, via 1) o intramolecolare (Ring Closing EnYne Metathesis, RCEYM) (Schema 2, via 2).
Schema 2
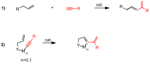
Le reazioni di metatesi sono conosciute da più di 40 anni, ma hanno ricevuto un enorme impulso, sia dal punto di vista dello studio meccanicistico, che da quello dello sviluppo delle loro possibili applicazioni sintetiche, solo quando si è arrivati alla sintesi di catalizzatori metallocarbenici a struttura ben definita.
I primi catalizzatori di questo genere sono stati i complessi immino carbenici del molibdeno (1), messi a punto da Schrock negli anni ’80, seguiti successivamente dai catalizzatori a base di rutenio (2, 3, 4) sviluppati da Grubbs (Figura 1).
Il professor Grubbs portò alla luce due generazioni di catalizzatori:
• Catalizzatori di prima generazione (2a e 2b)
• Catalizzatori di seconda generazione (3 e 4)
Figura 1
Come introduzione all’argomento mi fermo qui perché è sufficiente per spiegare la reazione, per ulteriori informazioni vi rimando ad un post di quimico riguardante le reazioni di metatesi olefinica: http://myttex.net/forum/Thread-Metatesi-di-olefine-e-non-solo?highlight=metatesi
STRUMENTAZIONE E VETRERIA NECESSARIA:
Per la distillazione del solvente
2 palloni di opportuna misura
Mucca (non conosco il vero nome di questo pezzo di vetreria, magari mi aiuterete voi per trovargli il nome giusto)
Mantello riscaldante
Valvole a cloruro di calcio
Stufa e cannello per anidrificare e fiammeggiare la vetreria
Per la reazione
Pallone a tre colli
Imbuto gocciolatore
Refrigerante a bolle
Linea di gas inerte (io ho usato argon)
Valvole a cloruro di calcio
Piastra riscaldante con bagno al silicone
REAGENTI:
Diclorometano (che verrà anidrificato tramite distillazione su anidride fosforica)
3-(ept-1-inil) acrilato
Cat. Grubbs II generazione (io ho usato quello che in figura 1 compare con il numero 3)
PROCEDIMENTO:
Distillazione del Diclorometano.
Si pone in stufa tutta la vetreria che si userà svitando in precedenza i rubinetti in teflon e gli “O-ring” in gomma. Si rimonta la vetreria e la si fiammeggia, il pallone di ebollizione viene riempito con 3 cucchiai di anidride fosforica e diclorometano fino a metà.Si procede a riscaldare il solvente fino a temperatura di ebollizione e lo si manda a riflusso per un paio di ore. Trascorse le 2 ore; tramite il rubinetto a più vie della “mucca” si procede a distillare il solvente. Si può procedere alla distillazione con l’accortezza di lasciare un piccolo volume nel pallone di ebollizione così da essere sicuri della purezza del solvente. Terminata la distillazione si chiude il pallone di raccolta con un setto in gomma e si procede a flussarci dentro un po’ di argon così da allontanare eventuali tracce di aria, in fine si sigilla il buco fatto con l’ago mediante l’uso di un po’ di parafilm. In questo modo si può conservare il diclorometano anidro anche per due settimane.




Reazione
In un pallone a tre colli da 500 ml, munito di refrigerante e imbuto di gocciolamento, il tutto preventivamente fiammeggiato, si pone 1.8 mmol (300 mg) di 3-(ept-1-inil) acrilato e 180 ml di CH2Cl2 anidro sotto agitazione magnetica e atmosfera inerte. Si riscalda la miscela a riflusso tramite bagno al silicone e nel frattempo si aggiunge goccia a goccia una soluzione di 79 mg di catalizzatore di seconda generazione (5% mol. rispetto al substrato) sciolti in 18 ml di CH2Cl2 anidro. Le aggiunte proseguono per un’ora e la miscela viene lasciata a riflusso per 16 ore, terminate le quali, dopo aver verificato la completezza della reazione mediante TLC, si procede alla purificazione tramite colonna cromatografica impaccata con gel di silice Merck-Kieselgel 60 (70-230 mesh) e la si eluisce con una miscela di etere di petrolio / etere etilico in rapporto 9:1. Si ottiene così il composto desiderato con una resa del 40% (120 mg).







Caratterizzazione
1H-NMR

13C-NMR
I seguenti utenti ringraziano Pomodoronda per questo messaggio: -Sandro-, fosgene, Max Fritz, quimico, Rusty