quimico
2011-11-19 11:44
Proseguiamo con un'altra interessante sintesi.
Anche in questo caso esistono diverse sintesi totali di questa molecola naturale. Riporto quella di Ian Paterson, che ancora una volta si dimostra abile e geniale nel proporre una sua sintesi totale. Per completare il discorso magari riporto brevemente le altre sintesi famose di questa molecola: Curran, modificazione di Fukui con composti fluorurati, Phillips e Ramachandran. Come potete vedere ci si è sbizzarriti in quegli anni  La dictiostatina (1, Schema 1) è un potente macrolide citotossico per la prima volta isolato da Pettit et al.[1] dalla spugna marina del genere Spongia sp., raccolta nella Repubblica delle Maldive, e,
in seguito, isolata da Wright e collaboratori[2] dalla spugna litistida della famiglia Corallistidae, raccolta a grandi profondità lungo le coste della Jamaica.
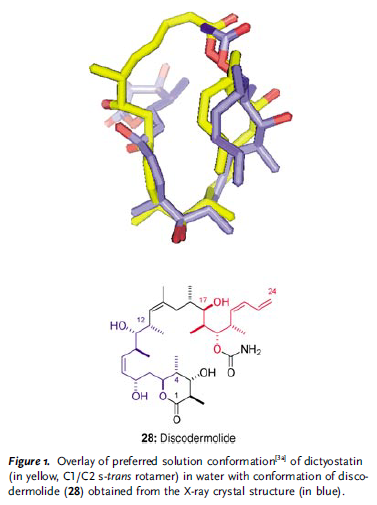
La struttura planare di questo macrolattore insaturo da 22 membri, che presenta 11 centri stereogenici, un 2Z,4E dienoato endociclico ed una funzione Z dienica esociclica al C21, fu dedotta da gruppo di Pettit, essenzialmente sulla base di dati spettroscopici 2D NMR.[1]
Recentemente, gli autori proposero una completa assegnazione stereochimica per la dictiostatina, come indicato in 1, basata su approfonditi esperimenti NMR ad alto campo, inclusa l'analisi configurazione di Murata basata sulle J, in combinazione con il modellamento molecolare.[3]
Sebbene non fosse stato possibili accertarsi la configurazione assoluta, l'assegnazioni fatta dagli autori si basò sul fatto che la dictiostatina fosse biogeneticamente correlata alla discodermolide.[4]
In particolare, la dictiostatina mostra una potente attività di inibizione della crescita nei contonti di un numero di cellule tumorali nell'uomo e nei sorci a basse concentrazioni nanomolare e, soprattutto, ritieni l'attività rispetto alle cellule tumorali resistenti al Tassolo espressa dalle P-glicoproteine attive. Studi preliminari sul meccanismo d'azione dimostrarono che la dictiostatina, in un modo simile al tassolo (paclitaxel), arresta le cellule nella fase G2/Mphase inducendo efficacemente la polimerizzazione tubulinica e sopprimento le normali dinamiche dei microtubuli, portando all'apoptosi.[2] Da ora, la dictiostatina rappresenta attualmente un promettente prodotto antimicotico naturale, un vantaggio per lo sviluppo della chemioterapica per i tumori, che fa parte del gruppo più importante di polichetidi che stabilizzano i microtubuli che include la laulimalide,[5] il peloruside A,[6] e la discodermolide.[7]
Sfortunatamente, la valutazione delle sue proprietà antitumorali è stata impedita per tanto tempo dalla abbondanza naturale così esigua.
Qui, gli autori hanno divulgato la prima sintesi totale della dictiostatina (1)
ed hanno stabilito inequivocabilmente la configurazione relativa ed assoluta di questo raro metabolita polichetide. Inoltre, l'approccio sintetico modulare è felssibile, altamente convergente, e stereocontrollato, e quindi offre il potenziale di fornire utili quantità di dictiostatina così come un range di derivati strutturali per iniziare gli studi di relazione struttura–attività.
La dictiostatina (1, Schema 1) è un potente macrolide citotossico per la prima volta isolato da Pettit et al.[1] dalla spugna marina del genere Spongia sp., raccolta nella Repubblica delle Maldive, e,
in seguito, isolata da Wright e collaboratori[2] dalla spugna litistida della famiglia Corallistidae, raccolta a grandi profondità lungo le coste della Jamaica.
La struttura planare di questo macrolattore insaturo da 22 membri, che presenta 11 centri stereogenici, un 2Z,4E dienoato endociclico ed una funzione Z dienica esociclica al C21, fu dedotta da gruppo di Pettit, essenzialmente sulla base di dati spettroscopici 2D NMR.[1]
Recentemente, gli autori proposero una completa assegnazione stereochimica per la dictiostatina, come indicato in 1, basata su approfonditi esperimenti NMR ad alto campo, inclusa l'analisi configurazione di Murata basata sulle J, in combinazione con il modellamento molecolare.[3]
Sebbene non fosse stato possibili accertarsi la configurazione assoluta, l'assegnazioni fatta dagli autori si basò sul fatto che la dictiostatina fosse biogeneticamente correlata alla discodermolide.[4]
In particolare, la dictiostatina mostra una potente attività di inibizione della crescita nei contonti di un numero di cellule tumorali nell'uomo e nei sorci a basse concentrazioni nanomolare e, soprattutto, ritieni l'attività rispetto alle cellule tumorali resistenti al Tassolo espressa dalle P-glicoproteine attive. Studi preliminari sul meccanismo d'azione dimostrarono che la dictiostatina, in un modo simile al tassolo (paclitaxel), arresta le cellule nella fase G2/Mphase inducendo efficacemente la polimerizzazione tubulinica e sopprimento le normali dinamiche dei microtubuli, portando all'apoptosi.[2] Da ora, la dictiostatina rappresenta attualmente un promettente prodotto antimicotico naturale, un vantaggio per lo sviluppo della chemioterapica per i tumori, che fa parte del gruppo più importante di polichetidi che stabilizzano i microtubuli che include la laulimalide,[5] il peloruside A,[6] e la discodermolide.[7]
Sfortunatamente, la valutazione delle sue proprietà antitumorali è stata impedita per tanto tempo dalla abbondanza naturale così esigua.
Qui, gli autori hanno divulgato la prima sintesi totale della dictiostatina (1)
ed hanno stabilito inequivocabilmente la configurazione relativa ed assoluta di questo raro metabolita polichetide. Inoltre, l'approccio sintetico modulare è felssibile, altamente convergente, e stereocontrollato, e quindi offre il potenziale di fornire utili quantità di dictiostatina così come un range di derivati strutturali per iniziare gli studi di relazione struttura–attività.
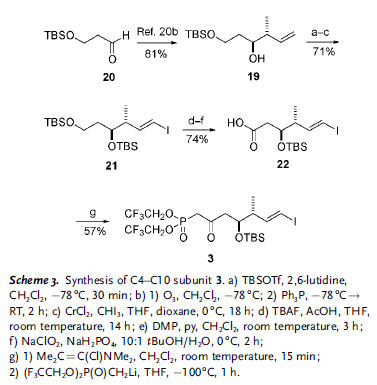
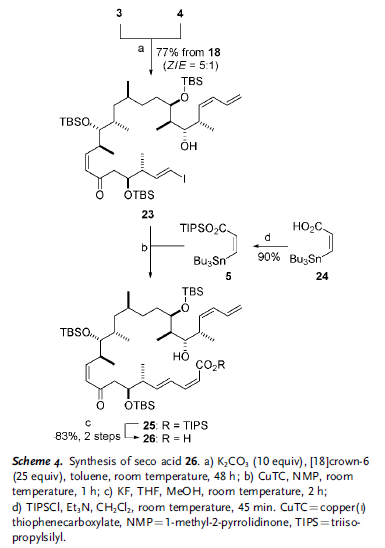
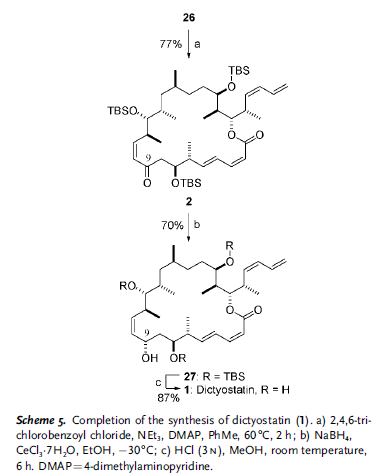
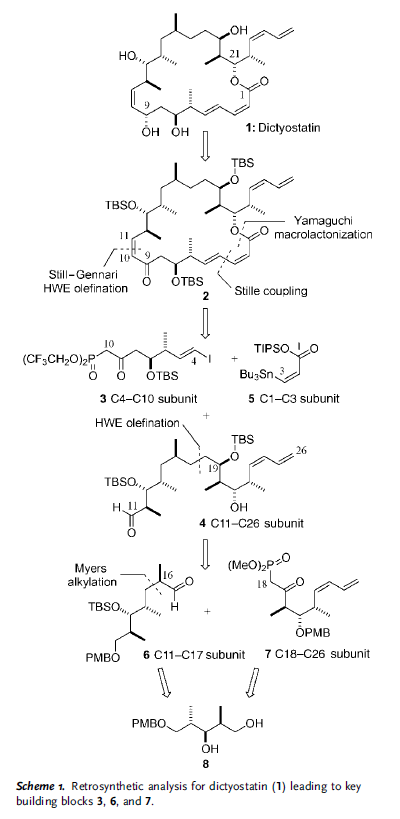 Come sottolineato retrosinteticamente nello Schema 1, il loro approccio si basa sulla riduzione all'ultimo stadio dell'enone 2, controllata dalla conformazione macrociclica adottata dall'anello a 22 membri; studi di molecular modeling[8] hanno indicato che l'addizione di idruro dovrebbe avvenire selettivamente per installare il richiesto stereocentro recante l'idrossile al C9. La funzionalità 10Z alchenica in 2 è stata pianificata derivare da un'olefinazione di tipo Still–Gennari tra il β-cheto fosfonato 3 e l'aldeide 4, insieme ad un cross-coupling di Stille col vinil stannano 5 per fare il 2Z,4E dienoato. In principio, entrambe queste due reazione potrebbero essere impiegate per chiudere il macrociclo come alternativa alla più convenzionale macrolattonizzazione di Yamaguchi, proponendo quindi una considerevole flessibilità nella sintesi.
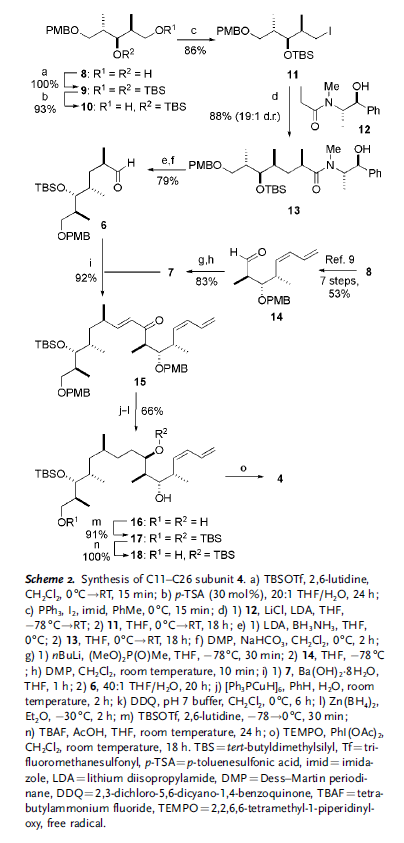
A sua volta, la subunità C11–C26 4 dovrebbe essere accessibile tramite un coupling di Horner–Wadsworth–Emmons (HWE) tra l'aldeide 6 ed il fosfonato 7, che contiene il diene Z terminale.
Dato che questi ultimi segmenti condividono una comune triade stereochimica, era atteso che entrambi 6 e 7 potessero essere preparati dall'intermedio comune 8, che è disponibile in quantità superiori al grammo tramite un'efficiente metodica aldolica riportata precedentemente dal loro gruppo.[9]
Come sottolineato retrosinteticamente nello Schema 1, il loro approccio si basa sulla riduzione all'ultimo stadio dell'enone 2, controllata dalla conformazione macrociclica adottata dall'anello a 22 membri; studi di molecular modeling[8] hanno indicato che l'addizione di idruro dovrebbe avvenire selettivamente per installare il richiesto stereocentro recante l'idrossile al C9. La funzionalità 10Z alchenica in 2 è stata pianificata derivare da un'olefinazione di tipo Still–Gennari tra il β-cheto fosfonato 3 e l'aldeide 4, insieme ad un cross-coupling di Stille col vinil stannano 5 per fare il 2Z,4E dienoato. In principio, entrambe queste due reazione potrebbero essere impiegate per chiudere il macrociclo come alternativa alla più convenzionale macrolattonizzazione di Yamaguchi, proponendo quindi una considerevole flessibilità nella sintesi.
A sua volta, la subunità C11–C26 4 dovrebbe essere accessibile tramite un coupling di Horner–Wadsworth–Emmons (HWE) tra l'aldeide 6 ed il fosfonato 7, che contiene il diene Z terminale.
Dato che questi ultimi segmenti condividono una comune triade stereochimica, era atteso che entrambi 6 e 7 potessero essere preparati dall'intermedio comune 8, che è disponibile in quantità superiori al grammo tramite un'efficiente metodica aldolica riportata precedentemente dal loro gruppo.[9]