chimica40
2020-12-30 15:57
Salve a tutti, ho delle difficoltà nel seguente esercizio:
L'idrossido di magnesio, Mg(OH)2 ha, a 25 C, il Ks=3,4x10^-11. Calcolare la solubilità del Mg(OH)2 in una soluzione a pH=10 e in una soluzione a pH=12.
In soluzione acquosa a pH 10:
[OH-]= 10^-4 M
per cui:
Mg(OH)2 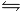 Mg2+ + 2OH-
Mg2+ + 2OH-
0 10^-4
s 2s
s 10^-4+2s
Ks = s (10^-4 + 2s)^2
Non riesco a continuare da questo punto in poi.. qualcuno, gentilmente, potrebbe spiegarmi i passaggi matematici necessari da seguire per ricavare la solubilità?
Grazie in anticipo
Bisogna risolvere l'equazione di terzo grado, che io so fare solo utilizzando un programma già impostato:
http://utenti.quipo.it/base5/numeri/equasolutore.htm
pH = 10
3,4·10^-11 = s (10^-8 + 4·10^-7s + 4s^2)
3,4·10^-11 = 10^-8s + 4·10^-4s^2 + 4s^3
4s^3 + 4·10^-4s^2 + 10^-8s - 3,4·10^-11 = 0
s = 1,72·10^-4 mol/L
Non è possibile adottare la risoluzione approssimata perché i valori ottenuti non sono confrontabili:
3,4·10^-11 = s (10^-4 + 2s)^2
3,4·10^-11 = 10^-8s
s = 3,4·10^-3 mol/L
pH = 12
3,4·10^-11 = s (10^-4 + 4·10^-2s + 4s^2)
3,4·10^-11 = 10^-4s + 4·10^-2s^2 + 4s^3
4s^3 + 4·10^-2s^2 + 10^-4s - 3,4·10^-11 = 0
s = 3,40·10^-7 mol/L
In questo caso è possibile adottare la risoluzione approssimata perché i valori ottenuti sono confrontabili:
3,4·10^-11 = s (10^-2 + 2s)^2
3,4·10^-11 = 10^-4s
s = 3,4·10^-7 mol/L
I seguenti utenti ringraziano LuiCap per questo messaggio: chimica40
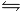 Mg2+ + 2OH-
Mg2+ + 2OH-