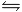"Per titolare 200 ml di una soluzione di ioduro di ammonio sono necessari 90,0 ml di una soluzione di idrossido di calcio avente pH 13,0. Calcolare il pH al punto equivalente". Non viene riportata la soluzione corretta perciò ho ancora più difficoltà ad orientarmi nella risoluzione.
Tentativo di risoluzione
Omettendo gli ioni spettatori, l'equazione relativa alla titolazione dovrebbe essere NH4+ + 2OH- <==> NH3 + H2O. Al p.e. suppongo che lo ione ammonio si sia trasformato in ammoniaca. Sempre che le mie supposizioni siano veritiere, dovrei poter ottenere la concentrazione di 2 mol di ioni idrossido nella maniera che segue:
pH + pOH = 14
pOH = 14-13 = 1
[2OH-] = 10^-1 = 0,1
A questo punto mi chiedo: la concentrazione di due moli di ioni idrossido corrisponde alla molarità di Ca(OH-)2 oppure è la metà della concentrazione di due moli di OH- a corrispondere alla sua M?
Ca(OH)2 --> Ca2+ + 2 OH-
Da 1 mol di Ca(OH)2 si ottengono 2 mol di OH-, perciò:
M Ca(OH)2 = 1/2 M OH-
M Ca(OH)2 = 0,1 mol/L / 2 = 0,05 mol/L
I seguenti utenti ringraziano LuiCap per questo messaggio: ddem
LuiCap ha scritto:
Ca(OH)2 --> Ca2+ + 2 OH-
Da 1 mol di Ca(OH)2 si ottengono 2 mol di OH-, perciò:
M Ca(OH)2 = 1/2 M OH-
M Ca(OH)2 = 0,1 mol/L / 2 = 0,05 mol/L
Appurato che M Ca(OH)2 = 0,05, dovrei calcolare la molarità di NH4I per avere dati sufficienti ad ottenere il pH al p.e. Proseguo nella maniera che segue:
Calcolo n Ca(OH)2
0,05:1 = x:0,09
x = 4,5*10^-3 mol
Se n Ca(OH)2 = nNH4I allora M NH4I = 4,5*10^-3/0,2 = 2,25*10^-2
In definitiva dovremmo avere 200 mL di NH4I 0,0225 titolati con 90 mL di Ca(OH)2 0,05 M.
Calcolo adesso la M di NH3 che dovrebbe essere pari a 4,5*10^-3/0,29 = 1,55*10^-2 da inserire nella tabella ICE.
NH3 + H2O <==> NH4+ + 2 OH-
1,55*10^-2../..........0...........0.......
-x................./..........+x........+2x......
1,55*10^-2 - x...../.....x............2x.........
Un attimo. Devo continuare a scrivere
LuiCap ha scritto:
Ca(OH)2 --> Ca2+ + 2 OH-
Da 1 mol di Ca(OH)2 si ottengono 2 mol di OH-, perciò:
M Ca(OH)2 = 1/2 M OH-
M Ca(OH)2 = 0,1 mol/L / 2 = 0,05 mol/L
Appurato che M Ca(OH)2 = 0,05, dovrei calcolare la molarità di NH4I per avere dati sufficienti ad ottenere il pH al p.e. Proseguo nella maniera che segue:
Calcolo n Ca(OH)2
0,05:1 = x:0,09
x = 4,5*10^-3 mol
Se n Ca(OH)2 = nNH4I allora M NH4I = 4,5*10^-3/0,2 = 2,25*10^-2
In definitiva dovremmo avere 200 mL di NH4I 0,0225 titolati con 90 mL di Ca(OH)2 0,05 M.
Calcolo adesso la M di NH3 che dovrebbe essere pari a 4,5*10^-3/0,29 = 1,55*10^-2 da inserire nella tabella ICE.
NH3 + H2O 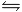 NH4+ + 2 OH-
NH4+ + 2 OH-
1,55*10^-2../..........0...........0.......
-x................./..........+x........+2x......
1,55*10^-2 - x...../.....x............2x.........
kb = [BH+][OH-]/
1,85*10^-5 = (x)(2x)/1,55*10^-2-x
Considerando la x al denominatore trascurabile solo per semplicità nel calcolo si avrà che
2,87*10^-7 = 2x^2
radq 1,43*10^-7 = radq x^2
x = 3,78*10^-4 = [OH-]
pOH = 3,42
pH = 10,58
Dal momento che non dispongo di una risposta corretta a cui fare riferimento, il procedimento che ho seguito è rigoroso o c'è qualche errore?
In forma molecolare la reazione che avviene nel corso della titolazione è:
2 NH4I + Ca(OH)2 --> CaI2 + 2 NH3 + 2 H2O
da cui:
2 mol NH4I = 1 mol Ca(OH)2
n Ca(OH)2 = 0,05 mol/L · 0,0900 L = 4,50·10^-3 mol
n NH4I = n NH3 = 4,50·10^-3 · 2 = 9,00·10^-3 mol
M NH3 = 9,00·10^-3 mol / 0,290 L = 0,0310 mol/L
OPPURE
In forma ionica la reazione che avviene nel corso della titolazione è:
NH4+ + OH- --> NH3 + H2O
da cui:
1 mol NH4+ = 1 mol OH-
n OH- = 0,1 mol/L · 0,0900 L = 9,00·10^-3 mol
n NH4+ = n NH3 = 9,00·10^-3 mol
M NH3 = 9,00·10^-3 mol / 0,290 L = 0,0310 mol/L
Il resto del procedimento è corretto, ma devi rifare i calcoli.
Scusami, non mi ero accorta che nel post iniziale avevi sbagliato il coefficiente degli OH-.
I seguenti utenti ringraziano LuiCap per questo messaggio: ddem
LuiCap ha scritto:
In forma molecolare la reazione che avviene nel corso della titolazione è:
2 NH4I + Ca(OH)2 --> CaI2 + 2 NH3 + 2 H2O
da cui:
2 mol NH4I = 1 mol Ca(OH)2
n Ca(OH)2 = 0,05 mol/L · 0,0900 L = 4,50·10^-3 mol
n NH4I = n NH3 = 4,50·10^-3 · 2 = 9,00·10^-3 mol
M NH3 = 9,00·10^-3 mol / 0,290 L = 0,0310 mol/L
OPPURE
In forma ionica la reazione che avviene nel corso della titolazione è:
NH4+ + OH- --> NH3 + H2O
da cui:
1 mol NH4+ = 1 mol OH-
n OH- = 0,1 mol/L · 0,0900 L = 9,00·10^-3 mol
n NH4+ = n NH3 = 9,00·10^-3 mol
M NH3 = 9,00·10^-3 mol / 0,290 L = 0,0310 mol/L
Il resto del procedimento è corretto, ma devi rifare i calcoli.
Scusami, non mi ero accorta che nel post iniziale avevi sbagliato il coefficiente degli OH-.
Ho capito di dover eliminare il coefficiente 2 da OH- per rimpiazzarlo con 1, il resto non mi torna, ricavo un valore diverso di OH-.
NH3 + H2O 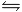 NH4+ + OH-
NH4+ + OH-
1,55*10^-2../..........0...........0.......
-x................./..........+x........+x......
1,55*10^-2 - x...../.....x............x.........
kb = [BH+][OH-]/
1,85*10^-5 = (x)(x)/1,55*10^-2-x
Considerando la x al denominatore trascurabile solo per semplicità nel calcolo si avrà che
x = 5,36*10^-4 = [OH-]
pOH = 3,27
pH = 10,73
La molarità dell'NH3 non è quella che hai scritto, ma quella che ho calcolato io nella precedente risposta 
NH3 + H2O <-->NH4+ + OH-
0,0310../.............0...........0
-x........./............+x........+x
0,0310-x.../..........x............x
1,85·10^-5 = x^2 / 0,0310 - x
x = [OH-] = radq (1,85·10^-5 · 0,0310) = 7,58·10^-4 mol/L
pOH = 3,12
pH = 10,88
I seguenti utenti ringraziano LuiCap per questo messaggio: ddem
LuiCap ha scritto:
La molarità dell'NH3 non è quella che hai scritto, ma quella che ho calcolato io nella precedente risposta 
NH3 + H2O <-->NH4+ + OH-
0,0310../.............0...........0
-x........./............+x........+x
0,0310-x.../..........x............x
1,85·10^-5 = x^2 / 0,0310 - x
x = [OH-] = radq (1,85·10^-5 · 0,0310) = 7,58·10^-4 mol/L
pOH = 3,12
pH = 10,88
Ora finalmente mi ritrovo nei tuoi calcoli, stavo perseguendo la via sbagliata. Il pH della soluzione iniziale di NH4I è invece 8.58, giusto? Riporto di seguito la risoluzione.
[OH-] = radq kb*cb
[OH-] = radq (1,8*10^-5)*(4,5*10^-2)
[OH-] = 3,82*10^-6
pOH = 5,42
pH = 8,58
Assolutamente no, erroraccio. 
Lo ione ammonio (NH4+) è l'acido coniugato della base debole NH3, perciò la soluzione iniziale ha sicuramente un pH acido:
n NH4I = 9,00·10^-3 mol
M NH4I = M NH4+ = 9,00·10^-3 / 0,200 L = 0,0450 mol/L
NH4+ + H2O <--> NH3 + H3O+
0,0450...../..............0.......0
-x............/..............+x.....+x
0,0450-x../................x.......x
Ka = Kw / Kb = 10^-14 /1,85·10^-5 = 5,41·10^-10
5,41·10^-10 = x^2 / 0,0450 - x
x = H3O+ = radq (5,41·10^-10 · 0,0450) = 4,93·10^-6 mol/L
pH = - log 4,93·10^-6 = 5,31
I seguenti utenti ringraziano LuiCap per questo messaggio: ddem, Geber