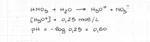fedex
2017-03-13 16:22
eserciatandomi mi è uscito un ennesimo dubbio sugli esercizi riguardanti il pH Un volume di 15.0 ml di una soluzione acquosa di ammoniaca ha richiesto l’aggiunta di 18.0 mL di soluzione di acido nitrico 0.25 M per arrivare al punto di equivalenza. Calcolare il pH delle due soluzioni di partenza. (Kb ammoniaca =1.8x10-5 ) allora l'esercizio chiede i pH delle soluzioni di partenza e non di quella finale per la soluzione di HNO3 non cè problema. è un acido forte quindi le moli di H30+ sono uguali alle moli di acido quindi 0.25*(18*10^-3)= 4.5*10^-3 faccio il logaritmo e viene pH=0.60 e ci siamo per la soluzione di NH3 so che le moli di OH- della soluzione saranno uguali alle moli di H3O+ della soluzione di aicido dato che il punto di equivalenza vuol dire che nOH-=nH3O+ quindi nella soluzione di ammoniaca dovrei avere 4.5*10^-3 moli di OH- ora se voglio la molarità faccio 4.5*10^-3 / 15*10^-3 =0.3 molare OH- bene essendo il pOH di una soluzione uguale al log negativo della molarita di OH- il pOH sarebbe 0.522 ed il pH=13.47 sbagliato. perchè? che c'entra in questo caso la kb se posso ottenere direttamente la misura degli OH-
fedex ha scritto:
eserciatandomi mi è uscito un ennesimo dubbio sugli esercizi riguardanti il pH Un volume di 15.0 ml di una soluzione acquosa di ammoniaca ha richiesto l’aggiunta di 18.0 mL di soluzione di acido nitrico 0.25 M per arrivare al punto di equivalenza. Calcolare il pH delle due soluzioni di partenza. (Kb ammoniaca =1.8x10-5 ) allora l'esercizio chiede i pH delle soluzioni di partenza e non di quella finale per la soluzione di HNO3 non cè problema. è un acido forte quindi le moli di H30+ sono uguali alle moli di acido quindi 0.25*(18*10^-3)= 4.5*10^-3 faccio il logaritmo e viene pH=0.60 e ci siamo per la soluzione di NH3 so che le moli di OH- della soluzione saranno uguali alle moli di H3O+ della soluzione di aicido dato che il punto di equivalenza vuol dire che nOH-=nH3O+ quindi nella soluzione di ammoniaca dovrei avere 4.5*10^-3 moli di OH- ora se voglio la molarità faccio 4.5*10^-3 / 15*10^-3 =0.3 molare OH- bene essendo il pOH di una soluzione uguale al log negativo della molarita di OH- il pOH sarebbe 0.522 ed il pH=13.47 sbagliato. perchè? che c'entra in questo caso la kb se posso ottenere direttamente la misura degli OH-
forse perche la concentrazione di OH- è uguale alla concentrazione di NH3? NH3+H20->NH4+ + OH- ( i coeff stechiometrici sono uguali)