Claudio
2017-05-31 00:27
Mi è capitato fra le mani questa brevetto nord americano US6103054
La cosa ha attirato subito la mia attenzione in quanto viene presentato come un dispositivo in grado di generare una tensione elettrica convertendo il calore ambiente direttamente in elettricità e sopratutto funziona senza che ci siano le classiche reazioni redox delle pile convenzionali, (questo è quanto viene dichiarato, la realtà è un po’ diversa come vedrete in seguito).
Questo dispositivo sfrutta come in tutte le pile la diversa elettronegatività fra elementi o composti che ne fanno parte , di seguito la tabella con l’ elettronegatività degli elementi secondo Pauling.
La pila è facilmente replicabile a patto di sostituire alcuni elementi con altri dalle proprietà elettriche equivalenti.
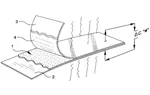
Secondo il brevetto americano, che descrive nei dettagli la preparazione del dispositivo, Il polo negativo della pila è costituito da una lastrina di Al o meglio Mg su cui viene spalmato un impasto di polvere di Cr2O3 e acetato di polivinile, PVAc, (la classica colla vinavil), il polo positivo è invece formato da una lastra di Cu su cui viene spalmato un impasto di polvere di fosforo rosso e acetato di polivinile, PVAc. Dopo aver fatto asciugare i due impasti le due lastre vengono accostate fra di loro e lievemente pressate per portare a contatto l’impasto di P con quello di Cr2O3 come si può osservare nell’immagine sottostante
1 P + PVAc , 2 lastra di Cu, 3 lastra di Al o Mg, 4 Cr2O3 + PVAc
L’unico elemento difficile da reperire è il fosforo rosso l’ho rimpiazzato alternativamente con 3 composti elettricamente conduttivi a mia disposizione con elettronegatività equivalente o superiore: C, MnO2, PbO2. S u questo dispositivo ho eseguito una serie di test preliminari, ed ho scoperto che non corrisponde al vero quanto viene affermato sull’assenza di reazioni redox nel dispositivo, la reazione esiste anche se è di lieve entità e ne è fattore determinante l’acqua intrappolata negli impasti a base di colla vinilica.
Infatti dopo aver preparato le 2 lastre metalliche con relativi impasti le avevo messe a seccare e poi sotto vuoto per eliminare la maggior parte dell’ acqua, ebbene queste 2 lastre non erano in grado di generare alcuna tensione in uscita nemmeno di lieve entità.
In un’altra preparazione invece ho accostato le 2 lastre con impasto quando questo era appena solidificato ma con ancora una certa quantità d’ H2O nell’impasto il dispositivo in questo caso ha generato una tensione elettrica .
Nel brevetto viene inoltre dichiarato che per avere una tensione in uscita condizione essenziale e che le due lastre metalliche esterne che raccolgono all’uscita la differenza di potenziale siano di metalli con diversa elettronegatività, anche questo è sbagliato, ho una cella che genera tensione con entrambe le lastre di uscita in alluminio
La tensione in uscita è determinata dall’elettronegatività dei 2 impasti interni contrapposti.
Di questo dispositivo ho realizzato 3 celle tutte con superficie attiva di 100 cm2
Cella 1: Al-Cr2O3.PVAc - - Grafite.PVAc-Al tensione in uscita a 32ºC 665 mV
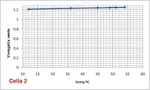
Cella 2: Al-Cr2O3.PVAc - - MnO2.PVAc-Grafite tensione in uscita a 50ºC 842 mV
Cella 3: Al-Cr2O3.PVAc - - PbO2.PVAc-Grafite tensione in uscita a 52ºC 1124 mV
La cella che ha dato le maggiori prestazioni è la 3 complice l’elevata elettronegatività e l’alta conduttività del diossido di piombo, il lato negativo di questo dispositivo è la resistenza medio alta del Cr2O3 che è un semiconduttore di tipo P, e che limita la corrente in uscita dal dispositivo, non sono riuscito a trovare un composto elettricamente equivalente a maggior conduttività per rimpiazzarlo.
Sotto foto delle 3 celle realizzate
Particolari costruttivi della cella 2, per le altre la disposizione è la stessa.
Le due lastrine che costituiscono gli elettrodi della pila, in questo caso grafite e Al sono contenuti dentro un busta di plastica chiusa per eliminare o per lo meno limitare l’evaporazione dell’acqua e tenuta pressata fra 2 lastre di vetro dalle 5 pinze (1). In (2) la cella estratta dalla busta con i 2 elementi ancora attaccati
In (3) l’elettrodo di Al con la miscela Cr2O3.PVAc e l’elettrodo in grafite con sopra la miscela di MnO2.PVAc, in (4) altro particolare dell’elettrodo positivo.
Misura della tensione della cella 1 esposta al sole
Misura della tensione della cella 2
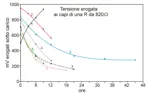
Sotto grafico della tensione erogata dalla cella 3 in funzione della temperatura, la cella è sotto carico, con una resistenza da 22Kohm in serie
Sulla cella 3 a temperatura ambiente ho fatto anche una prova a lungo termine sempre con resistenza di carico da 22Kohm inserita
La cella 3 è rimasta attiva con carico attaccato per 15 gg con costante diminuzione della tensione che alla fine si è ridotta a 50 mV, probabilmente si è consumata parte dell’acqua contenuta nella struttura.
Strumenti usati per i test sulle celle: tester, amplificatore ad elevata impedenza d’ingresso, data logger, PC.
Conclusioni : la cella funziona però la corrente fornita è piccola dell’ordine 0,5 µA /cm2: una struttura con superficie attiva di 1 m2 fornirebbe una corrente di soli 5 mA. Questa pila mi ricorda un po’ gli elementi della pila Zamboni che usa l’umidità dell’aria per funzionare.
I seguenti utenti ringraziano Claudio per questo messaggio: NaClO, quimico, fosgene, luigi_67, zodd01, MarcoA










 è quella del Rossi con la sua E-cat. Lo confesso, ne sono un vero appassionato
è quella del Rossi con la sua E-cat. Lo confesso, ne sono un vero appassionato 