quimico
2011-09-28 21:50
Il gruppo fenile e i benzeni polisostituiti sono intermedi chiave di grande utilità nella chimica di sintesi e in quella dei prodotti naturali, nella chimica medica e nelle scienze dei materiali. I derivati bifenilici idrossilati si ritrovano in un grande numero di composti naturali, quali ad esempio vancomicina, bifenomicina ed ellagitannini.1 Tuttavia, la preparazione di composti aromatici polisostituiti in generale e in particolare dei bifenili è stata un'area affascinante in sintesio organica.2 I classici approcci sono basati sulla sostituzione aromatica, che introduce un sostituente sull'anello benzenico. Metodologie sintetiche basate su questa via sono state sviluppate: includono sostituzioni elettrofile3 o nucleofile4, reazioni di coupling5 catalizzate da metalli di transizione, e reazioni di metallazione-funzionalizzazione.6 Comunque, questi approcci hanno alcuni svantaggi dal punto di vista dell'atom economy7 o per quanto riguarda l'ambiente. I metodi che costruiscono il framento aromatico da precursori aciclici hanno ricevuto un crescente interesse a causa dei loro pochi step sintetici e della natura selettiva.8 Questi aspetti generali sono comuni nelle maggiori reazioni di benzannulazione che coinvolgono ciclizzazioni inter- ed intramolecolari, cicloaddizioni e reazioni di benzannulazione,9-16 sintesi di acetofenoni e metil benzoati tramite reazioni di 1,3-dinitroalcani con derivati 2-ene-1,4-dionici o 2-ene-4-osso esteri,17 e tramite una strategia di annulazione [4+2] dalla reazione di Baylis-Hillman.18 Riferimenti: (1) (a) Nicolaou, K. C.; Boddy, C. N. C.; Brase, S.; Winssinger, N. Angew. Chem. Int. Ed. 1999, 38, 2096–2152. (b) Hubbard, B. K.; Walsh, C. T. Angew. Chem. Int. Ed. 2003, 42, 730–765. (c) Schimana, J.; Gebhardt, K.; Holtzel, A.; Schmid, D. G.; Sussmuth, R.; Muller, J.; Pukall, R.; Fiedler, H. P. J. Antibiot. 2002, 55, 565–570. (d) Ezaki, M.; Iwami, M.;Yamashita, M.; Komori, T.; Umehara, K.; Imanaka, H. Appl. Environ. Microb. 1992, 58, 3879–3882. (e) Quideau, S.; Feldman, K. S. Chem. Rev. 1996, 96, 475–503; (f) Feldman, K. S. Phytochemistry 2005, 66, 1984–2000. (2) Astrue, D. Modern Arene Chemistry; Ed. Wiley-VCH: Weinheim, Germany, 2002. (3) (a) Olah, G. Friedel-Crafts and Related Reactions; Wiley Interscience: New York, 1963; Vols. I-IV. (b) Pearson, D. E.; Buehler, C. A. Synthesis 1972, 533-542. (4) (a) Smith, M. B.; March, J. Advanced Organic Chemistry, 5th ed.; Wiley-Interscience: New York, 2001; Ch. 13, p 850. (b) Buncel, E.; Dust, J. M.; Terrier, F. Chem. Rev. 1995, 95, 2261-2280. (5) Hassan, J.; Se´vignon, M.; Gozzi, C.; Schulz, E.; Lemaire, M. Chem. Rev. 2002, 102, 1359-1469. (6) Snieckus, V. Chem. Rev. 1990, 90, 879-933. (7) (a) Trost, B. M. Science 1991, 254, 1471-1477. (b) Trost, B. M. Angew. Chem. Int. Ed. Engl. 1995, 34, 259-281. (8) Saito, S.; Yamamoto, Y. Chem. Rev. 2000, 100, 2901-2915 and references cited therein. (9) (a) Dotz, K. H.; Tomuschat, P. Chem. Soc. Rev. 1999, 28, 187-198. (b) Wang, H.; Huang, J.; Wulff, W. D.; Rheingold, A. L. JACS 2003, 125, 8980-9891. (c) Vorogushin, A. V.; Wulff, W. D.; Hansen, H. J. JACS 2002, 124, 6512-6513. (10) (a) Danheiser, R. L.; Brisbois, R. G.; Kowalczyk, J. J.; Miller, R. F. JACS 1990, 112, 3093-3100. (b) Danheiser, R. L.; Gee, S. K. JOC 1984, 49, 1672-1674. (11) (a) Xi, Z.; Sato, K.; Gao, Y.; Lu, J.; Takahashi, T. JACS 2003, 125, 9568-9569. (b) Takahashi, T.; Ishikawa, M.; Huo, S. JACS 2002, 124, 388-389. (12) Bonaga, L. V. R.; Zhang, H. C.; Moretto, A. F.; Ye, H.; Gauthier, D. A.; Li, J.; Leo, G. C.; Maryanoff, B. E. JACS 2005, 127, 3473-3485. (13) (a) Asao, N.; Nogami, T.; Lee, S.; Yamamoto, Y. JACS 2003, 125, 10921-10925. (b) Asao, N.; Takahashi, K.; Lee, S.; Kasahara, T.; Yamamoto, Y. JACS 2002, 124, 12650-12651. (c) Asao, N.; Aikawa, H.; Yamamoto, Y. JACS 2004, 126,7458-7459. (14) (a) Langer, P.; Bose, G. Angew. Chem. Int. Ed. 2003, 42, 4033-4036. (b) Katritzky, A. R.; Li, J.; Xie, L. Tetrahedron 1999, 55, 8263-8293. (15) (a) Serra, S.; Fuganti, C.; Moro, A. JOC 2001, 66, 7883-7888. (b) Turnbull, P.; Moore, H. W. JOC 1995, 60, 644-679. (16) (a) Bi, X.; Dong, D.; Liu, Q.; Pan, W.; Zhao, L.; Li, B. JACS 2005, 127, 4578-4579. (b) Barun, O.; Nandi, S.; Panda, K.; Ila, H.; Junjappa, H. JOC 2002, 67, 5398-5401. (17) Ballini, R.; Barboni, L.; Fiorini, D.; Giarlo, G.; Palmieri, A. Chem. Commun. 2005, 2633-2634. (18) Lee, M. J.; Lee, K. Y.; Gowrisankar, S.; Kim, J. N. Tetrahedron Letters 2006, 47, 1355-1358.
Sinonimi: 1,1'-bifenile, difenile (sebbene possa intendersi anche altro), bibenzene, carolide AL, lemonene, fenador-x, fenilbenzene, PhPh, tetrosina LY, xenene Usi: intermedio di sintesi, fluido scambiatore di calore, fungicida Formula molecolare: C6H5-C6H5 CAS No: 92-52-4 EC No: 202-163-5 Annex I Index No: 601-042-00-8 Aspetto: cristalli bianchi m.p.: 70 °C b.p.: 255 °C Densità di vapore: 5.3 (air = 1) Pressione di vapore: 0.005 mmHg a 20 °C Densità (gcm-3): 1.04 Flash point: 110 °C (closed cup) Limiti infiammabilità: 0.6 - 5.8% Temperatura di autoignizione: 540 °C Solubilità in acqua: insolubile Stabile. Combustibile. Incompatibile con forti agenti ossidanti. Irritante per pelle, occhi e tratto respiratorio.
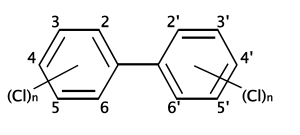
 . Il fatto che ci siano solo due atomi di cloro, e che entrambi gli atomi di cloro siano in una posizione orto dovrebbe tendere a rendere questo congenero di PCB meno tossico del caso in cui il congenere contenga sei atomi di cloro, ma gli atomi di cloro sono mancanti in tutte le quattro posizioni orto (C-2, C-6, C-2' e C-6'
. Il fatto che ci siano solo due atomi di cloro, e che entrambi gli atomi di cloro siano in una posizione orto dovrebbe tendere a rendere questo congenero di PCB meno tossico del caso in cui il congenere contenga sei atomi di cloro, ma gli atomi di cloro sono mancanti in tutte le quattro posizioni orto (C-2, C-6, C-2' e C-6'