MicheleMar
2020-12-07 20:47
Buonasera, non mi è chiaro del perchè una curva di titolazione di un acido debole parta ad un ph più elevato rispetto ad un acido forte. Ringrazio in anticipo per le risposte.
Un acido forte, completamente dissociato in soluzione acquosa, ha un pH che equivale alla sua concentrazione (sebbene la questione sia ben più complessa e articolata, si tende a semplificare in questo modo).
HCl → H+ + Cl–
Quindi quando si titola un acido forte con una base forte, il pH iniziale corrisponde alla concentrazione dell'acido prima dell'aggiunta di base. Se si considera l'acido cloridrico 0,1 M, il pH iniziale sarà 1.
pH = – log[H3O+] = – log Ca
Quando si inizia ad aggiungere una base forte come NaOH, il pH inizierà a salire di valore perché l'aggiunta di base forte comporta la reazione degli ioni H3O+ con gli ioni OH– provenienti dalla base, in una reazione di neutralizzazione. Arrivato al punto di equivalenza, la concentrazione degli ioni H3O+ sarà uguale a quelle degli ioni OH– e il pH sarà 7. Aggiungendo ancora NaOH, il pH inizierà ad essere sempre più basico perché ormai l'HCl è stato completamente neutralizzato.
HCl + NaOH → NaCl + H2O
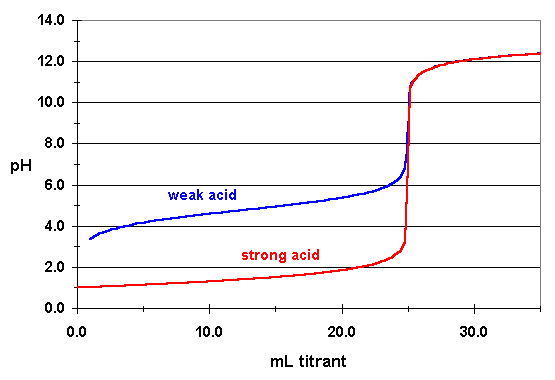
Al contrario, un acido debole è solo parzialmente dissociato in soluzione acquosa, ovvero solo un po' degli ioni H3O+ saranno dissolti mentre la gran parte dell'acido sarà indissociato. Quindi la concentrazione degli ioni H3O+ non sarà uguale alla concentrazione dell’acido e bisogna tener conto della costante di dissociazione acida Ka.
pH = – log √Ka ∙ [HA]
Il pH sarà acido ma non come quanto accadeva per l'acido forte. Se si considera un classico acido debole come l'acido acetico CH3COOH, ad una concentrazione 0,1 M (come nel caso dell'HCl) il suo pH iniziale è circa 2,89.
CH3COOH + H2O ⇄ CH3COO– + H3O+
All'inizio della sua titolazione, quindi senza che sia stata ancora aggiunta base forte come NaOH, il pH è acido e resta tale fino alla completa neutralizzazione dell'acido. Il pH aumenta fino ad arrivare anche qui al punto di equivalenza: le moli di OH– sono uguali alle moli di CH3COOH nell'analita. Gli ioni H3O+ sono completamente neutralizzati dagli ioni OH–.
Attenzione che al punto di equivalenza, rispetto a quanto accade per la titolazione di un acido forte, il pH è BASICO. Questo accade perché CH3COO– essendo base coniugata di un acid debole, è base forte e quindi introduce ioni OH– in soluzione che ne aumentano il pH fino a circa 9.
I seguenti utenti ringraziano Geber per questo messaggio: MicheleMar