danclem98
2021-04-19 11:26
0,3 g acido cloridrico sono aggiunti a 0,5 L di una soluzione 0,1 M di diidrogenofosfato di sodio. Calcolare il pH della soluzione ottenuta.
Ho provato a svolgerlo ma ho dei dubbi su come va scritta la reazione. Ho un sale e un acido forte, ma non so i prodotti come dovrebbero uscire. Se fosse stato un sale e una base forte sarebbe uscito sale + base forte 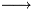 base debole + sale + acqua se non vado errato. Avendo l'acido forte come bisogna comportarsi? Si tratta di un tampone?
Vi mando l'esercizio svolto fin dove mi sono bloccato con la reazione. Purtroppo non posso scansionare.
SVOLGIMENTO:
nHCL = m/Pm = 0,3g/36,458g/mol = 0,00822 mol HCL
n NaH2PO4= MxV= 0,1 mol/L x 0,5 L = 0,05 mol NaH2PO4
NaH2PO4 + HCL
base debole + sale + acqua se non vado errato. Avendo l'acido forte come bisogna comportarsi? Si tratta di un tampone?
Vi mando l'esercizio svolto fin dove mi sono bloccato con la reazione. Purtroppo non posso scansionare.
SVOLGIMENTO:
nHCL = m/Pm = 0,3g/36,458g/mol = 0,00822 mol HCL
n NaH2PO4= MxV= 0,1 mol/L x 0,5 L = 0,05 mol NaH2PO4
NaH2PO4 + HCL 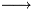 H3PO4 + NaCL
0,05 0,00822 / /
- 0,00822 -0,00822 +0,00822 +0,00822
0,041 / 0,00822 0,00822
Alla fine mi trovo secondo la reazione un sale basico (NaH2PO4) un acido debole (H3PO4) e Cloruro di sodio ma mi sembra un po' assurdo anche perchè non saprei come continuare. Come andrebbe svolto? Spero sia comprensibile. Grazie a tutti
H3PO4 + NaCL
0,05 0,00822 / /
- 0,00822 -0,00822 +0,00822 +0,00822
0,041 / 0,00822 0,00822
Alla fine mi trovo secondo la reazione un sale basico (NaH2PO4) un acido debole (H3PO4) e Cloruro di sodio ma mi sembra un po' assurdo anche perchè non saprei come continuare. Come andrebbe svolto? Spero sia comprensibile. Grazie a tutti
Inizia con lo scrivere bene l'acido cloridrico! Gli elementi hanno dei simboli precisi. Il cloro ha per simbolo Cl e NON CL...
Inizierei calcolando la concentrazione di acido cloridrico dopo la miscelazione:
nHCl = 0,3 g / (36,458 g/mol) = 0,0082 mol
[HCl] = 0,0082 mol / 0,5L = 0,016 M
Il monoidrogenofosfato di sodio si dissocia in
Na2HPO4 → 2 Na+ + HPO42–
mentre in soluzione acquosa, l’acido cloridrico libera ioni H3O+ in concentrazione pari a 0,016 M:
HCl + H2O → H3O+ + Cl–
Gli ioni idronio liberati vanno a spostare gli equilibri che vedono lo ione monoidrogenofosfato come protagonista, formando una quantità uguale di ione diidrogenofosfato:
HPO42– + H3O+ → H2PO4– + H2O
Pertanto, dopo aver unito le due soluzioni, le concentrazioni diventeranno:
[HPO42–] = 0,1 M – 0,016 M = 0,084 M
[H2PO4–] = 0,016 M
L’aggiunta di un acido forte alla soluzione di monoidrogenofosfato di sodio ha dato origine ad una soluzione tampone.
Per calcolare il pH della soluzione si può usare l’equazione di Henderson-Hasselbalch, relativa al seguente equilibrio:
H2PO4– + H2O = HPO42– + H3O+
con Ka2 = 7,9·10–8. Quindi:
pH = pKa2 + log ([HPO42–]/[H2PO4–]) = 7,10 + log (0,084/0,016) = 7,82
Tenendo conto del numero corretto di cifre significative, il pH della soluzione vale 7,8.
I seguenti utenti ringraziano Geber per questo messaggio: danclem98
danclem98
2021-04-19 12:30
Però scusami perche all'inizio hai dissociato il monoidrogenofosfato di sodio? Il problema mi da il diidrogenofosfato di sodio. Comunque penso sia lo stesso ragionamento
Quindi per il futuro mi conviene scrivere due semireazioni se si tratta di un sale e un acido forte e poi ricavare la reazione finale. E se al posto di HCl avessi avuto il sale NaH2PO4 più base forte tipo LiOH avrei dovuto seguire lo stesso ragionamento? Scusami se sto scrivendo una boiata XD
Comunque grazie tante sei stato gentilissimo
In forma ionica la reazione che avviene è:
H+ + Cl- + Na+ + H2PO4- --> H3PO4 + Cl- + Na+
n H+ = 0,3 g / 36,46 g/mol = 0,0082 mol
n H2PO4- = 0,1 mol/L · 0,5 L = 0,05 mol
Fra i due ioni avviene una reazione che può essere considerata completa:
H2PO4- + H+ --> H3PO4
0,05.......0,0082.....0
-0,0082..-0,0082.....+0,0082
0,042.........0..........0,0082
In 0,5 L di soluzione restano 0,042 mol di base debole H2PO4- e si formano 0,0082 mol del suo acido coniugato H2PO4-: è una soluzione tampone!!!
H3PO4 + H2O <--> H2PO4- + H3O+
0,0082......./.............0,042......0
-x............../.............+x..........+x
0,0082-x..../.............0,042+x....x
Ka = 6,9·10^-3 · [(0,0082-x)/0,5 / (0,042+x)/0,5
Risolvendo l'equazione di 2° grado senza trascurare la x come termine additivo e sottrattivo si ha:
x = [H3O+] = 1,14·10^-3 mol/L
pH = 2,94
Trascurando la x si ha:
x = [H3O+] = 1,36·10^-3 mol/L
pH = 2,87
Se si dovessero rispettare le cifre significative dei dati forniti dal testo, si dovrebbero esprimere tutti i risultati con una sola cifra significativa, il che non mi pare corretto. 
I seguenti utenti ringraziano LuiCap per questo messaggio: danclem98
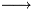 base debole + sale + acqua se non vado errato. Avendo l'acido forte come bisogna comportarsi? Si tratta di un tampone?
Vi mando l'esercizio svolto fin dove mi sono bloccato con la reazione. Purtroppo non posso scansionare.
SVOLGIMENTO:
nHCL = m/Pm = 0,3g/36,458g/mol = 0,00822 mol HCL
n NaH2PO4= MxV= 0,1 mol/L x 0,5 L = 0,05 mol NaH2PO4
NaH2PO4 + HCL
base debole + sale + acqua se non vado errato. Avendo l'acido forte come bisogna comportarsi? Si tratta di un tampone?
Vi mando l'esercizio svolto fin dove mi sono bloccato con la reazione. Purtroppo non posso scansionare.
SVOLGIMENTO:
nHCL = m/Pm = 0,3g/36,458g/mol = 0,00822 mol HCL
n NaH2PO4= MxV= 0,1 mol/L x 0,5 L = 0,05 mol NaH2PO4
NaH2PO4 + HCL 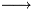 H3PO4 + NaCL
0,05 0,00822 / /
- 0,00822 -0,00822 +0,00822 +0,00822
0,041 / 0,00822 0,00822
Alla fine mi trovo secondo la reazione un sale basico (NaH2PO4) un acido debole (H3PO4) e Cloruro di sodio ma mi sembra un po' assurdo anche perchè non saprei come continuare. Come andrebbe svolto? Spero sia comprensibile. Grazie a tutti
H3PO4 + NaCL
0,05 0,00822 / /
- 0,00822 -0,00822 +0,00822 +0,00822
0,041 / 0,00822 0,00822
Alla fine mi trovo secondo la reazione un sale basico (NaH2PO4) un acido debole (H3PO4) e Cloruro di sodio ma mi sembra un po' assurdo anche perchè non saprei come continuare. Come andrebbe svolto? Spero sia comprensibile. Grazie a tutti
