cristinab
2015-02-22 10:07
Buondì 
sono nuova e non molto pratica del forum  Mi sto preparando per l'esame di chimica e cercando tra le simulazioni d'esame mi sono imbattuta in domande di cui non capisco nemmeno la traccia
Mi sto preparando per l'esame di chimica e cercando tra le simulazioni d'esame mi sono imbattuta in domande di cui non capisco nemmeno la traccia 
Partendo dal presupposto che sono ancora un pò ignorante in materia (per adesso ho studiato solo la teoria e mi rimangono 20 giorni da dedicare agli esercizi), vi posto le domande sperando che qualcuno mi possa aiutare 
1. Un orbitale molecolare II:
A) Si ottiene dalla sovrapposizione di due orbitali p ortogonali
B) Si ottiene dalla sovrapposizione di due orbitali p coassiali
C) Può contenere al massimo due elettroni
D) Si ottiene dalla sovrapposizione di due orbitali s
E) Si ottiene dalla sovrapposizione di un orbitale s con un orbitale p
2. In quale delle seguenti condizioni una reazione spontanea è endotermica?
A) ΔH < 0 B) ΔH = ΔS C) ΔG = 0 D) ΔG >0 E) ΔH < (T × ΔS)
3. Per neutralizzare completamente 10ml di H3PO4 1M occorre aggiungere:
A) 30ml di Ca(OH)2 2M
B) 15ml di Ca(OH)2 2M
C) 30ml di Ca(OH)2 0,5 M
D) 15ml di Ca(OH)2 0,5 M
E) 30ml di Ca(OH)2 1M
4. La base coniugata dello ione P207 ^4- è:
5. Quale dei seguenti sistemi tampone è più efficiente a tamponare una soluzione a pOH = 11?
A) NaHS/H2S (pk a1= 6.96)
B) Na2HPO4/NaH2PO4 (pk a2 = 7.21)
C) CH3COONa/CH3COOH (pk a = 4.75)
D) NaNO2/HNO2 (pk a = 3.33)
E) NaCN/HCN (pk a = 9.31)
6. Quale delle seguenti soluzioni possiede osmolarità più elevata:
A) Na2SO4 0,5 M B) NaCl 1M C) HNO2 1,5M (α=0,5) D) urea 3M E) Na3PO4 0,5M
7. Per una reazione esotermica, l’energia di attivazione:
A) della reazione diretta è identica a quella inversa
B) è la differenza tra energia dei reagenti e dei prodotti
C) è la tonalità termica della reazione
D) della reazione diretta è superiore a quella inversa
E) della reazione diretta è inferiore a quella inversa
8. Data la reazione esotermica all’equilibrio in fase gassosa 2NH3 <--> N2+3H2 un’aggiunta di N2 provocherà:
A) diminuzione di NH3
B) diminuzione di H2
C) aumento di H2
D) nessun effetto
E) aumento della costante di equilibrio
9. Il pOH di una soluzione di CH3COOH (pk a = 4.75) è 9.25. Pertanto:
A) CH3COOH > CH3COO -
B) CH3COOH < CH3COO -
C) CH3COOH = CH3COO -
D) CH3COOH + H2O = CH3COO -
E) CH3COO - +H20 = CH3COOH
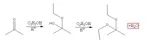
10. Dalla reazione tra CH3-CO-CH3 e C2H5-OH si ottiene:
11. Il punto isoelettrico della glicina è 6,1. Pertanto a pH 10:
A) non è ionizzata
B) è carica positivamente
C) sottoposta ad elettroforesi migrerà verso il polo negativo
D) prevale la forma anionica
E) avrà carica netta = 0
12. Quale dei seguenti legami stabilizza la struttura secondaria delle proteine?
A) legami fosfoesterei tra residui di fosfoserina
B) ponti disolfuro tra residui di cisteina
C) interazioni idrofobiche tra residui di fenilalanina
D) legami glicosidici tra le catene laterali
E) legami ad idrogeno tra gruppi peptidici
13. Quale di questi legami è coinvolto nella stabilizzazione della struttura secondaria degli acidi nucleici?
A) legami fosfoanidridici tra i nucleotidi
B) interazioni di van der waals tra le coppie di basi
C) ponti salini tra i fosfati
D) legami ammidici tra basi azotate
E) nessuna di queste interazioni
ESERCIZIO 1. Una soluzione ottenuta sciogliendo 0.92 g di acido formico (PM=46) in 500ml presenta un pOH di 11. Calcolare grado di dissociazione dell’acido.
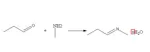
ESERCIZIO 2. Scrivere la reazione tra propanale e metil-ammina riportando le formule di struttura di reagenti e prodotti.