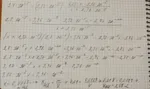In effetti, quella di avere un pH pari a 4,5 è una condizione che si impone successivamente, cioè non è propria della soluzione del litro di acido acetico 0,1 M. Perciò anche io, se avessi fatto più attenzione, probabilmente avrei inserito quel valore 3,16*10^-5 nella riga delle variazioni/del delta. Non so se sia questa la motivazione che devo darmi però questa soltanto sono riuscita a elaborare. Il riferimento è alla risoluzione, la prima in assoluto.
Esatto, è proprio così!!!
Dopodiché mi chiedo perché l'equilibrio della reazione CH3COOH + OH- --> CH3COO- + H2O sia spostato verso destra. Non è una reazione reversibile? Cioè.. Sì.. Immagino lo sia, come tante altre.. Usare la doppia freccia allora cosa significa? Che si è instaurato un equilibrio ovvero che le reazioni (quelle che formano reagenti, quelle che formano prodotti) procedono alla stessa velocità? Per quale motivo dovrei discriminare tra una freccia e l'altra, la singola e la doppia? Tante volte a quella reazione è stata associata una doppia freccia, ora diventa singola. Non capisco.
A rigore, tutte le reazioni devono essere considerate di equilibrio. Il valore numerico della costante di equilibrio ci dice però se la reazione è spostata verso i reagenti o verso i prodotti:
- quanto più la Keq è minore di uno, tanto più la reazione è spostata verso i reagenti;
- quanto più la Keq è maggiore di uno, tanto più la reazione è spostata verso i prodotti; se Keq è >> 1, la reazione può essere considerata completa.
Consideriamo in un primo momento la seguente reazione come una reazione di equilibrio, quindi scriviamo la doppia freccia:
CH3COOH + OH- <--> CH3COO- + H2O
Calcoliamo la Keq della reazione:
Keq = [CH3COO-] / [CH3COOH][OH-]
Poiché:
[OH-] = Kw/[H+]
sostituiamo:
Keq = [CH3COO-][H+] / [CH3COOH]Kw
Poiché:
Keq = [CH3COO-][H+] / [CH3COOH] = Ka (CH3COOH)
avremo:
Keq = Ka/Kw = 1,8·10^-5/1,0·10^-14 = 1,8·10^9
Con un valore così elevato della costante di equilibrio si può concludere che la reazione tra l'acido debole acido acetico e la base forte ioni idrossido è una reazione completa, perciò si può scrivere la reazione con la freccia singola:
CH3COOH + OH- --> CH3COO- + H2O
In generale, tutte le reazioni che portano alla formazione di un prodotto poco dissociato (in questo caso l'H2O) possono tranquillamenter essere considerate complete. Altri esempi sono le reazioni di precipitazione, di complessazione, le redox spontanee, ecc.
Mi rendo conto di muovermi fin troppo meccanicamente, alle volte accetto di non comprendere perciò sono d'accordo, ho sicuramente delle carenze nella comprensione perché dovrei poter discutere faccia a faccia con una persona per risolvere le mie perplessità, a volte troppe rispetto a quelle che riporto. Mi rendo conto anche di ripetermi ovvero di domandarti più volte la stessa cosa, che tu stessa con tanta dedizione mi hai spiegato, ma ripeto: la comprensione non è assoluta e alcune lacune, pur di procedere, le colmo usando uno schema più che un ragionamento motivato. Così a volte l'esercizio mi dà perché casualmente ho usato il giusto procedimento risolutivo, altre volte non mi torna. Forse mi sono oltraggiata un pochino troppo, forse non sono così pietosa. Capisco per lo più quello che combino però c'è sicuramente più di qualcosa che mi sfugge. Ho un testo di riferimento, il famoso Kotz di chimica generale, il mio primo e unico testo di chimica. Tutto quello che so, l'ho tratto da questo testo. Mi rendo conto che sia valido ma anche che vada un pochetto integrato. Forse avrei bisogno di sentirmi spiegare un concetto diversamente, forse non avrei bisogno di quelle omissioni che sono così inopportune per chi comincia a studiare per la prima volta la chimica da più in alto di un libro delle superiori. Alle volte levi così velocemente l'oscurità da certe perplessità al punto che mi chiedo perché non l'avessi capito prima. Parole diverse, probabilmente. L'interazione col docente serve, per non dire che è indispensabile. Tutto questo l'ho specificato per chiederti di avere pazienza. So di rompere le scatole, so di sembrare una deficiente e aggiungo che più tardi, probabilmente domani, posterò il tentativo di risoluzione del tuo esercizio. Grazie per il tuo prezioso aiuto, non lo sottovaluto.
Non ho mai considerato, né considererò "deficiente" una persona che si applica e cerca di superare le difficoltà studiando. Pazienza e tempo, per ora, ne ho!!!

 CH3COO- + H2O sia spostato verso destra. Non è una reazione reversibile? Cioè.. Sì.. Immagino lo sia, come tante altre.. Usare la doppia freccia allora cosa significa? Che si è instaurato un equilibrio ovvero che le reazioni (quelle che formano reagenti, quelle che formano prodotti) procedono alla stessa velocità? Per quale motivo dovrei discriminare tra una freccia e l'altra, la singola e la doppia? Tante volte a quella reazione è stata associata una doppia freccia, ora diventa singola. Non capisco.
CH3COO- + H2O sia spostato verso destra. Non è una reazione reversibile? Cioè.. Sì.. Immagino lo sia, come tante altre.. Usare la doppia freccia allora cosa significa? Che si è instaurato un equilibrio ovvero che le reazioni (quelle che formano reagenti, quelle che formano prodotti) procedono alla stessa velocità? Per quale motivo dovrei discriminare tra una freccia e l'altra, la singola e la doppia? Tante volte a quella reazione è stata associata una doppia freccia, ora diventa singola. Non capisco.