danclem98
2021-04-20 15:39
Buonasera a tutti ho svolto questo esercizio e penso possa andare bene però volevo un confronto. Vi mando l'esercizio svolto con il ragionamento. Grazie a tutti 
PROBLEMA:
0,3 grammi di idrossido di potassio sono aggiunti a 0,6 L di una soluzione 0,1 M di monoidrogenofosfato di sodio. Calcolare il pH della soluzione ottenuta.
SVOLGIMENTO:
n KHO= m KHO/ Pm KHO= 0,3(g)/56,1056(g/mol)= 0,00534(mol) KHO
n Na2HPO4= M x V = 0,1(mol/L) x 0,6 (L)= 0,06(mol) Na2HPO4
Reazione
2Na+ + HPO4(2-) + K+ + OH- 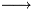 PO4(3-) + H2O +
PO4(3-) + H2O + 2Na+ + K+
HPO4(2-) + OH- 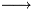 PO4(3-) + H2O
PO4(3-) + H2O
Si tratta di una reazione tra un acido debole e una base forte e si forma una soluzione tampone HPO4(2-)/PO4(3-)
Tabella ICE:
HPO4(2-) + OH- 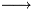 PO4(3-) + H2O
PO4(3-) + H2O
0,06 0,00534 / /
-0,00534 -0,00534 +0,00534 +0,00534
0,05466 / 0,00534 0,00534
Mi avanza HPO4(2-) che è un acido debole e la sua base coniugata
[H+]= Ka HPO4(2-) X na/ns = (2,2x10^-13) x 0,05466(mol)/0,00534(mol)= 2,25x10^-12
pH=-log(2,25X10^-12)= 11,65
Il pH ha senso che è fortemente basico perchè l'acido è debole. Fatemi sapere se è corretto come ragionamento.