quimico
2011-08-23 09:55
Visto che è stata richiesta altrove mi pare cosa buona e giusta, parlarne un po'. Se riesco inserisco anche delle immagini prese da un libro autorevole di chimica organica. Iniziamo.
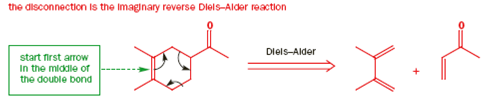
Quando si parla della Diels-Alder si parla del più famoso esempio di reazione periciclica; ovvero gli elettroni si muovono attorno in cerchio e non ci sono cariche positive o negative su un qualsiasi intermedio, anzi non ci sono proprio intermedi.
Questa reazione avviene in un unico step semplicemente tramite riscaldamento. Possiamo disegnare il meccanismo tramite gli elettroni che si muovono in cerchio attorno ad un anello a sei membri.
Ogni freccia porta direttamente alla successiva, e l'ultima freccia connette alla prima. Abbiamo disegnato gli elettroni che si muovono in senso orario, ma non avrebbe fatto differenza alla fine se avessimo fatto ruotare gli elettroni in senso antiorario.
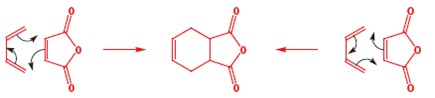
Entrambi i meccanismi sono ugualmente corretti. Gli elettroni non ruotano davvero alla fine. In realtà due legami π spariscono e due orbitali σ prendono il loro posto attraverso il movimento circolare degli elettroni che si muovono facilmente fuori dagli orbitali π negli orbitali σ. Una reazione di questo tipo si chiama cicloaddizione.
È meglio spendere alcune parole per far capire cosa possa esser successo.
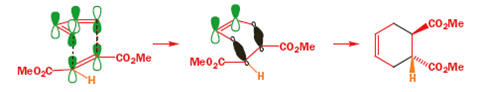
Primo, consideriamo solo gli orbitali che si sovrappongono per formare i nuovi legami. Ammesso che i reagenti si avvicinino nel giusto modo, niente potrebbe essere più semplice.
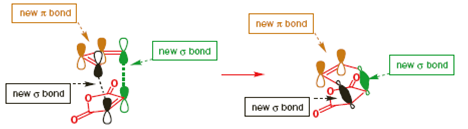
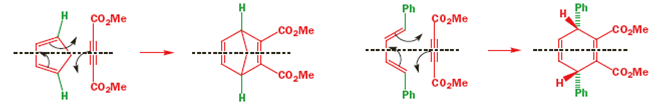
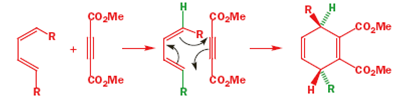
Gli orbitali p (in nero) sono perfettamente allineati per formare il nuovo legame σ come i due orbitali in verde, mentre i due orbitali in marrone sono esattamente giusti per il nuovo legame π dietro l'anello. Poiché questa è una reazione di un solo step non ci sono intermedi ma un solo stato di transizione che appare qualcosa tipo questo sotto.
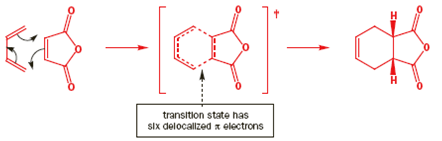
Una reazione per cui la reazione di Diels-Alder va così bene è che lo stato di transizione ha sei elettroni π delocalizzati e quindi ha un carattere aromatico, avendo qualcosa della stabilizzazione propria di un anello di benzene. Questa semplice immagine è buona, ma incompleta.
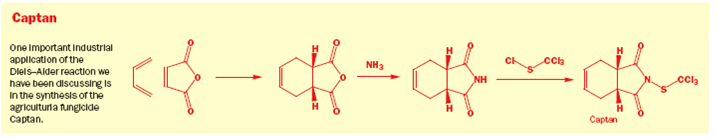
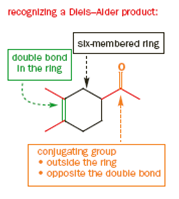
Descrizione generale della reazione di Diels-Alder
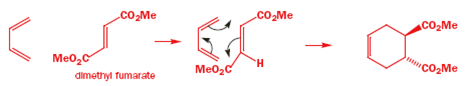
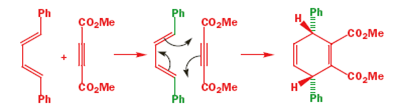
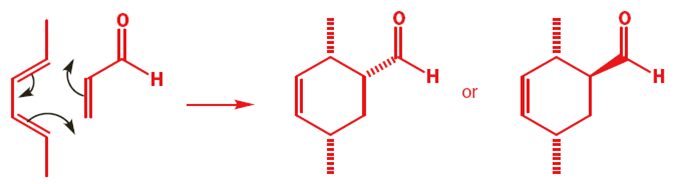
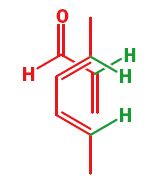
Le reazione di Diels-Alder avvengono tra un diene coniugato e un alchene, di solito chiamato il dienofilo. Qui sono riportati alcuni esempi: prima un diene a catena aperta con una semplice aldeide insatura che fa da dienofilo.
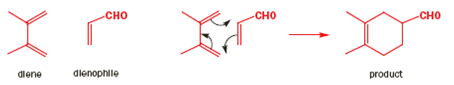
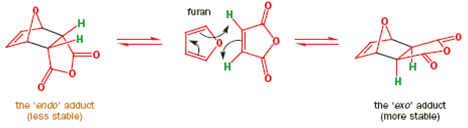
Il meccanismo è il medesimo e il nuovo anello a sei membri che si forma ha un doppio legame. Ora vediamo una reazione tra un diene ciclico ed un nitroalchene.
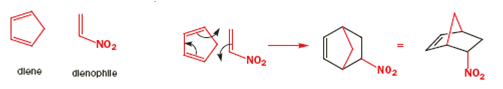
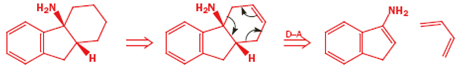
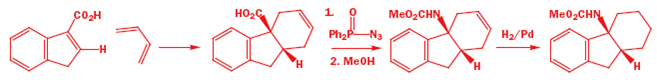
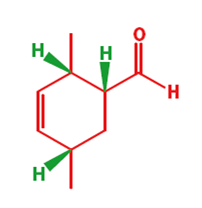
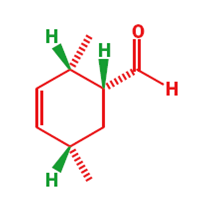
Il meccanismo porta chiaramente al primo disegno del prodotto ma questa è una struttura a gabbia ed il secondo disegno è meglio. Il nuovo anello a sei membri è sottolineato in nero in entrambi gli schemi. Ora un più elaborato esempio per mostare che molecole abbastanza complesse possono essere assemblate con questa meravigliosa reazione.
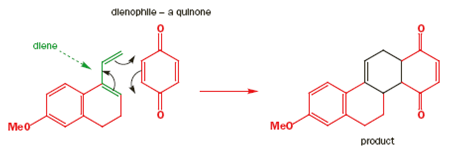
Il diene
Il componente dienico nella Diels-Alder può essere aciclico o ciclico e può avere diversi differenti tipi di sostituenti. C'è solo una limitazione: esso deve essere in grado di assumere la conformazione mostrata nel meccanismo.
Il butadiene normalmente preferisce la conformazione s-trans con i due doppi legami il più lontano possibile l'uno dell'altro per ragioni steriche. La barriera rotazionale attorno al legame centrale σ è piccola (ca. 30 kJ/mol a t.a.) e la rotazione alla conformazione s-cis meno favorita ma reattiva è rapida.
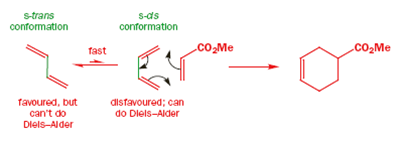
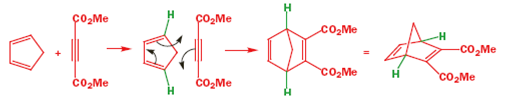
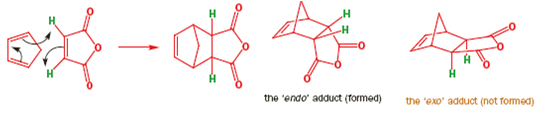
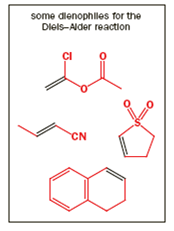
I dieni ciclici che sono permanentemente nella conformazione s-cis sono eccezionalmente buoni per la reazione di Diels-Alder - il ciclopentadiene è un esempio classico - ma i dieni ciclici che sono permanentemente nella conformazione s-trans e che non possono quindi adottare la conformazione s-cis alla fine non faranno mai la reazione di Diels-Alder. Le due estremità di questi dieni non possono avvicinarsi abbastanza per reagire con un alchene e, in qualsiasi caso, il prodotto dovrebbe avere un impossibile doppio legame trans nel nuovo anello a sei membri
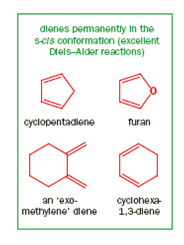
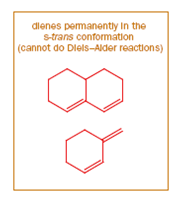
Il dienofilo
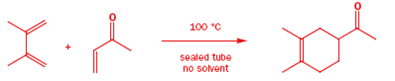
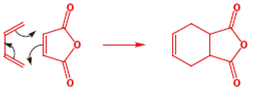
I dienofili visti in azione finora hanno tutti una cosa in comune: ha tutti un gruppo elettron-attrattore coniugato all'alchene. Questo è un aspetto comune difficile non esclusivo dei dienofili delle Diels-Alder. Ci deve essere altra coniugazione extra (almeno un gruppo fenile o un atomo di cloro) o la cicloaddizione non avverrà. Sui libri avrete sempre visto un esempio di Diels-Alder tra il butadiene e un alchene semplice (addirittura l'etilene). Questa reazione avviene ma con rese misere.
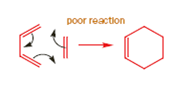
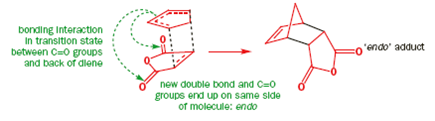
I tentativi di combinare perfino un diene reattivo come il ciclopentadiene con un semplice alchene conduce invece alla dimerizzazione del diene. Una molecola agisce da diene e l'altra come dienofilo a dare la struttura a gabbia riportata.
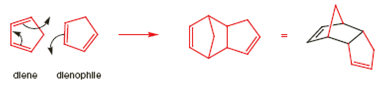
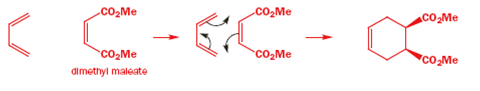
Semplici alcheni che subiscono la reazione di Diels-Alder inclusono composti carbonilici coniugati, nitro composti, nitrili, sulfoni, alcheni arilici, vinil eteri ed esteri, alogeno alcheni, e dieni.
I seguenti utenti ringraziano quimico per questo messaggio: lorenzo, mkuw_