Ciao a tutti
Scusatemi se non mi son fatto più vivo....problemi con il lavoro 
Ora vi posto alcuni esercizi che ho svolto ed altri che proprio non so riuscito a fare...... son uscito di testa  non capisco dove sbaglio...
non capisco dove sbaglio...
se per favore mi aiutate ne sarei veramente grato
ESERCIZI CHE NON RIESCO A RISOLVERE:
1) In un recipiente chiuso vengono introdotti cianuro di ammonio ed ammoniaca alla temperatura di 100°C. La temperatura viene portata a 300°C e si stabilisce l’equilibrio secondo la reazione:
NH4CN(s) <==> NH3(g)+HCN(g)
Le pressioni iniziali a 100°C e finali a 300°C sono rispettivamente 0.1 atm e 1976 mmHg. Calcolare la costante di equilibrio della reazione a 300°C. In che direzione e perché si sposta l’equilibrio se introduciamo azoto?
2) Un composto di formula ABC2 subisce decomposizione termica secondo la seguente reazione (da bilanciare):
ABC2(g) <==> AC2(s)+AB(g)+BC2(g)
Un eccesso di ABC2 viene riscaldato da 12°C a 582°C in un recipiente chiuso contente azoto e BC2 gassoso in rapporto molare 2:1. Le pressioni iniziali a 12°C e finali a 582°C sono rispettivamente 0.4 atm e 1216 mmHg. Calcolare la costante di equilibrio della reazione a 582°C.
3) In un recipiente chiuso vengono introdotti carbonato di ammonio ed ammoniaca alla temperatura di 22°C ed alla pressione di 0.7 atm. La miscela viene portata a 130°C e si instaura il seguente equilibrio (reazione da bilanciare):
(NH4)2CO3(s) CO2(s) + NH3(g) + H2O(g)
La pressione finale risulta 37 atm. Determinare KP e KC della reazione a 130°C e la composizione percentuale in volume della fase gassosa. Stabilire se e in che direzione si sposta l’equilibrio se diminuisce il volume del recipiente.
Nota bene : non ci troviamo in fase omogenea, Giusto? abbiamo sostanze solide e gassose quindi......  aiuto....
aiuto....
ESERCIZI SVOLTI
1) In un recipiente di volume 0.500L, in un esperimento si è visto che dopo aver posto 0.100 moli di Co,0.250 moli di H2 e 0.0250 moli di CH3OH, si stabilisce il seguente equilibrio :
CO+2H2 <==> CH3OH
alla T=120°C con la concentrazione finale di CH3OH di 4.30*10-3M . Calcolare il Kc alla T=120°C
SOLUZIONE
CO+2H2 <==> CH3OH
mi trovo la molarità iniziale
[CO2]=0.100moli/0.500L=0.200M
[H2]=0.250moli/0.500L=0.500M
[CH3OH]=0.0250moli/0.500L=0.0500M
sapendo che la concentrazione finale di [CH3OH]=4.30*10-3 è più piccola di quella iniziale, con X indico la variazione della concentrazione;
Quindi
CO + 2H2 <==> CH3OH
Concen. iniziali 0.200 0.500 0.0500
variazione +x +2x -x
Concen. finale 0.200+x 0.500+2x 0.0500-x
il valore di X lo calcolo così
[CH3OH]= 0.0500-x=4.30*10-3M
X=0.0500-4.30*10-3=0.0457M
sostituisco in CO2 e H2 e ho
[CO2]=0.200+x=0.200+0.0457=0.2457M
[H2]=0.500+2x=0.500+2*0.0457=0.591M
Trovo
Kc=[CH3OH]/[CO2]*[H2]^2=5.00*10-2
2) A 100°C e alla presiione di 30 atm, le frazioni molari per la reazione:
C(s)+CO2(g) <==>2CO(g)
sono Xco2=0.17 , Xco=0.83. Calcolare la Kp alla T=100°C
SOLUZIONE
Ptot= 30 atm trovo le pressioni parziali
Pco2=Xco2*Ptot=0.17*30=5.1atm
Pco=Xco*Ptot=0.83*30=24.9atm
Kp=(Pco)^2/(Pco2)=(24.9)^2/(5.1)=121.5
3) La costante di equilibrio a 723°C per la reazione
A(g)+B(g) <==>C(g)
vale 50 atm. In un recipiente a pareti chiuse ha volume di 50L ; vengono immerse 1 moli e di A e 1 mole di B Calcolare le concentrazioni delle specie gassose all'equilibrio. Vengono poi immerse 0.2 moli di B .Calcolare le nuove concentrazioni all'equilibrio.
SOLUZIONE
devo trovarmi Kp che è
Kp=(Pc)/(PA)*(PB)
Uso la legge dei gas perfetti per trovarmi le pressini parziali di A e B , visto che il n° di moli sono uguali (1mole di A e di B)
T=273+723°C=996K
P(A=B)=nRT/V=1.63atm
La variazione è
A(g) + B(g) <==>C(g)
pressioni parz. inizio 1.63 1.63 0
variaz. -x -x +x
equilibrio 1.63-x 1.63-x +x
scrivo la Kp in funzione di x
Kp=(Pc)/(PA)*(PB)=x/(1.63-x)^2=50
risolvendo l'eq. di 2° X=1.44atm
Pertanto sostituisco X nelle pressioni parziali è ho
A=0.19atm
B=0.19atm
C=1.44atm
Calcolo le nuove concentrazioni trovandomi le moli
moli(A=B) PV/RT=0.12 moli
moliC=PV/RT=0.88 moli
le conc. sono
[A]==moli/V=2.4*10-3M
[C]=moli/V=17.6*10-3M
Inserisco ora 0.2 moli di B, significa un incremento della pressione parziale di B pari a 1.63*0.2= 0.33 atm, riutilizzo lo schema di prima dove ora la pressione iniziale di B sarà
1.63+0.33atm=1.96
A(g) + B(g) <==>C(g)
pressioni parz. inizio 1.63 1.96 0
variaz. -x -x +x
equilibrio 1.63-x 1.96-x +x
scrivo la Kp in funzione di x
Kp=(Pc)/(PA)*(PB)=x/(1.63-x)*(1.96-x) =50
risolvendo l'eq. di 2° X=1.56atm
A=1.63-1.56=0.07atm
B=1.93-1.56=0.4atm
C=1.56atm
Calcolo le nuove concentrazioni trovandomi le moli
moli A= PV/RT=0.04 moli
moli B= PV/RT=0.24 moli
moli C= PV/RT=0.96moli
le conc. nuove sono
[A]=moli/V=8*10-4M
=moli/V=4.8*10-3M
[C]=moli/V=1.92*10-2M
Grazie Sempre a tutti quelli che lo leggono
 ciò troppe cose da ricordarmi e da fare..
ciò troppe cose da ricordarmi e da fare.. 
 passo-passo
passo-passo
 il solito sbadato......! ma ti assicuro che lo scritto così...
il solito sbadato......! ma ti assicuro che lo scritto così... 
 non capisco dove sbaglio...
non capisco dove sbaglio...



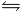 NH3(g)+HCN(g)
NH3(g)+HCN(g)


 (mi cerca il mio datore di lavoro.....
(mi cerca il mio datore di lavoro.....  )
)





