marco the chemistry
2014-07-02 12:57
Quando si insegna la chimica organica sia alle superiori che all'università gli acetali e i chetali vengono molto trascurati e questi non se ne parla, anche se sono una classe di composti molto interessanti e pure utili, soprattutto come gruppi protettivi resistenti alle basi e che vengono eliminati in condizioni molto blande. La loro preparazione è teoricamente molto semplice, ma praticamente lo è un po' meno, poichè la formazione di questa classi di composti è un equilibrio non troppo spostato verso i prodotti (come invece avviene con l'esterificazione di Fisher)... Occorre perciò eliminare uno dei prodotti, sicuramente la scelta cade sull'acqua, ma anche la sua eliminazione non è così scontata...
Materiali:
- cicloesanone
- glicole etilenico
- acido p-toluensolfonico
- benzene (o toluene o cicloesano)
- NaOH
Procedimento:
In un pallone da 250ml si pongono 20,3ml di cicloesanone, 22,4ml di glicole etilenico (2 equiv) e circa un grammo di acido p-toluensolfonico, si agita per dissolvere l'acido e si aggiungono quindi circa 100ml di benzene. Per cause di forza maggiore ho lasciato riposare la miscela una notte. La mattina dopo la soluzione si era divisa in due fasi. Si bolle quindi a riflusso per un'oretta e poi distilla il benzene fino a quando il solvente condensato non diventa limpido. Per maggior scrupolo ho provveduto a separare l'acqua trasportata per distillazione azeotropica dal benzene e ho ripetuto la distillazione, separando ancora una piccola dose di acqua.
Dopo aver fatto raffreddare si pone la soluzione in imbuto separatore e la si lava con una soluzione concentrata di NaOH, per eliminare il catalizzatore acido, e poi con acqua fino a neutralità, infine si anidrifica con NaOH in pellet.
Ora si fraziona il liquido limpido ottenuto: fino a 100° distilla abbondantemente il benzene, che viene anidrificato e rettificato, la temperatura sale poi velocemente intorno a 150°, qui distilla il cicloesanone residuo e infine arriviamo a 175° temperatura alla quale distilla praticamente tutto il prodotto desiderato. La temperatura sale fino a circa 180°, ma ormai il pallone non contiene più nulla, il glicole etilenico in grande eccesso è quindi stato eliminato tutto con i lavaggi con acqua. Il prodotto si presenta come un liquido incolore con un aroma fruttato ed etereo, piacevole.
Resa 12,4g (44%). La resa fa abbastanza schifo, ma come ho detto all'inizio non è facile eliminare tutta l'acqua formata durante la reazione, almeno non con i mezzi a mia disposizione..servirebbe la comodissima trappola di Dean-Stark, ma non riesco a trovarla... . Ho notato che intorno a 150° è distillata una gran quantità di prodotto, costituito praticamente da cicloesanone puro e non reagito nonostante l'eccesso del 100% di glicole etilenico..
. Ho notato che intorno a 150° è distillata una gran quantità di prodotto, costituito praticamente da cicloesanone puro e non reagito nonostante l'eccesso del 100% di glicole etilenico..
I seguenti utenti ringraziano marco the chemistry per questo messaggio: fosgene, quimico, Dott.MorenoZolghetti, MaXiMo, al-ham-bic

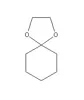
 questo.
questo.