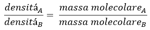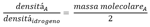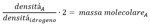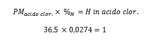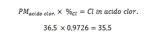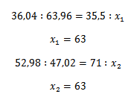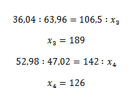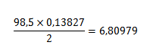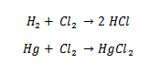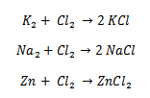zodd01
2017-08-07 23:27
Buonasera,
ammetto di non essere sicuro di aver azzeccato la sezione, in caso che i moderatori spostino.
Può sembrare stupido ma vi assicuro che questa discussione che sto aprendo è necessaria.
Voi penserete " eh vabbè in un forum di chimica c'è bisogno di parlare della teoria atomica ? "
Rispondo di sì, maledettamente sì.
Immagino che tutti noi studenti universitari abbiamo fatto e pure bene la chimica generale: atomo, nucleo, protoni, elettroni, orbitali, numero atomico, di massa, modello di Bohr e compagnia bella ma alla fine, chi e come ha dato prova che gli atomi esistono ? E sopratutto come ha fatto ben prima che arrivassero i potenti strumenti con la spina e i geniacci della fisica ? Perchè iniziamo col dire questo, la prova della veridicità della teoria atomica è già arrivata nella seconda metà dell'800 ben prima di Einstein e colleghi e non dalla fisica ma dalla chimica, con un contributo non trascurabile della chimica organica. Mentre ancora i fisici litigavano fra loro, in chimica organica si disegnavano già le strutture ( esatte ) del benzene. La persona a cui dobbiamo la teoria atomica è Stanislao Cannizzaro e questa discussione si occupa di riesumare il metodo con cui ha validato la teoria atomica togliendo la confusione che ancora regnava. Ho frequentato due università italiane e in nessuna di queste si fa bene il metodo di Cannizzaro, adesso che lo conosco ho capito che non si può non sapere come chimici il metodo Cannizzaro. Non sapere equivale a non sapere dove si sta di casa, è inaccettabile che in chimica non si sappia il suo metodo. E' una grave mancanza che spero almeno di dare spunto qui a colmare.
Iniziamo. Dai gas. L'ipotesi atomica fu avanzata dai fisici che studiavano i gas e non solo. Cannizzaro fa sua l'ipotesi di Avogadro secondo il quale volumi uguali di gas diversi, alla stessa temperatura e pressione, contengono un uguale numero di molecole. Questa ipotesi viene dalle legge delle proporzioni definite. Facendo reagire dei gas si vede che questi si combinano secondo proporzioni definite, se uno dei due reagenti é in eccesso rimane non reagito. Allora ad Avogadro venne in mente una idea:
" Ma non é che uguali volumi di gas contengono lo stesso numero di particelle ? "
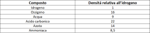
Le conseguenze di questa ipotesi sono enormi. Ammettiamo volessimo trovare i pesi, anzi meglio le masse degli elementi o dei composti gassosi che abbiamo. Una bilancia atomica e una pinzetta atomica non l'abbiamo per prendere una singola particella e pesarla singolarmente. Tuttavia ne possiamo pesare tante di particelle. Giá ai tempi di Avogadro erano state misurate le densitá di molti gas tramite l'apparecchio di Dumas e, vedendosi l'idrogeno essere il meno denso - o volgarmente il piú leggero - fu preso come riferimento. Le densitá di vari gas espresse come relative a quella dell'idrogeno. Nella tabella di seguito vengono riportati alcuni valori, all'occhio giá vediamo che ci ricordano qualcosa...
Se ci si riflette bene, anzi ci si medita proprio sulla ipotesi di Avogadro, si conclude che pesando volumi uguali di due gas diversi, alle stesse condizioni, si sta pesando lo stesso numero di particelle di gas e il rapporto fra le due densitá é lo stesso del rapporto fra le masse di particelle singole dei due gas.
Mi spiego meglio. Dalla tabella vediamo che un volume di ossigeno ha densitá pari a 16 volte quella dell'idrogeno. Se noi potessimo pesare una particella singola di ossigeno avremmo che questa é 16 volte il peso di quella dell'idrogeno. In maniera rigorosa diciamo che il rapporto fra le densitá di due gas é uguale al rapporto delle masse delle loro singole particelle - che siano atomi o molecole -. Con una formula matematica scriviamo cosí:
Ora siccome l’idrogeno é di riferimento, il gas B dentro quella formula é l'idrogeno. Arrivati a questo punto sorge spontanea una domanda:
" Ma l'idrogeno, cui si é preso come riferimento, é fatto di particelle singole o combinate ? Cioé é fatto di atomi o molecole ? "
Questo é importante. Se noi sapessimo che é fatto di molecole allora il riferimento sarebbe l'atomo di idrogeno non la sua molecola. Di conseguenza in quella formula, al denominatore a destra dovremmo mettere 2, 3 a seconda di quanti atomi é composta la molecola di idrogeno. Cannizzaro, sia nel suo libro che ai suoi studenti, salta la parte dove dimostra che l'idrogeno é H2 e la mette all'ultimo. Dice per motivi didattici e per non confondere il lettore, qui assume biatomica la molecola di idrogeno e mette 2 sotto a quella formula. Io faccio lo stesso ma vi anticipo che tramite le proporzioni definite e la stechiometria delle reazioni con l'idrogeno si deduce che esso é per forza H2. Quindi la formula sopra diventa:
Cioé moltiplicando per 2 il rapporto fra le densitá di un gas e dell'idrogeno si ottiene la massa molecolare ( o atomica ) relativa del gas - volgarmente detta peso molecolare ( o atomico ) -.
Vedete quanto è grande la portata della ipotesi di Avogadro ? Senza bilance e pinzette molecolari ma da una semplice misura di una proprietá macroscopica si ottiene una cosí importante proprietá microscopica.
Fu misurato, così, il peso molecolare di diversi composti gassosi o gassificabili.
La domanda successiva è: questi composti, sono appunto composti o corpi semplici ? Qual è il rapporto fra i costituenti ? In parole povere, qual è la formula minima ? Per rispondere a questa domanda Cannizzaro procedette così. Si fa l’analisi elementare e, a meno che non si trovi che la sostanza è composta da un unico tipo di materia, si ottengono il tipo di corpi semplici di cui è composto e le percentuali di essi. Queste percentuali però si devono riflettere in qualsiasi quantitá del composto in esame. Facciamo un esempio. Dall’analisi elementare dell’acido cloridrico si ottiene che è composto da idrogeno e cloro nelle percentuali rispettive di 2,74% e 97,26%. Sia che si analizzi 1 grammo di acido cloridrico, 0,1 grammo, 0,001 grammo o una singola molecola le percentuali di questi elementi sono sempre le stesse. Se noi potessimo pesare una singola molecole, moltiplicando la sua massa per queste percentuali espressi in centesimi, otterremmo la massa di ogni elemento in questa molecola. Ma una molecola singola non la possiamo pesare, ma di nuovo ne possiamo pesare tante: abbiamo cioé al posto della massa molecolare quella relativa.
Se ci si medita nuovamente a fondo sulla ipotesi di Avogadro, deduciamo che aver espresso la masse molecolari come relative a quella dell'atomo di idrogeno, non cambia il rapporto fra gli elementi in un composto. Quindi moltiplicando quelle percentuali di idrogeno e cloro per la massa molecolare relativa - volgarmente detta peso molecolare - dell'acido cloridrico otteniamo il contributo di questi due elementi al peso molecolare dell'acido cloridrico, cioé la massa relativa di ogni elemento in questa molecola.
Facciamo due conti per spiegarci meglio.
Dalle misure scritte poc’anzi risulta che l’acido cloridrico ha peso molecolare relativo 36,50. Moltiplicando questo valore per la percentuale analitica di idrogeno otteniamo:
Stessa cosa col cloro
Quindi l’idrogeno contribuisce con 1 e il cloro con 35,5 al peso molecolare dell’acido cloridrico. Vediamo quindi, che di atomi di idrogeno ce n'é uno solo. Ma quanti cloro ? Continua...
Parte 2
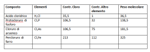
Il valore di massa relativa 35,5 per l'elemento cloro nell'acido cloridrico a quanti atomi di cloro corrisponde ? E’ dunque la formula minima dell’acido cloridrico HCl o HCl2, HCl3 ....? Lo scopriamo facendo lo stesso giochino con altri composti contenenti cloro di cui conosciamo il peso molecolare. Facciamo l’analisi elementare e poi moltiplichiamo le percentuali per il peso molecolare. Saltiamo i calcoli e passiamo direttamente ai risultati in tabella:
Qui vediamo che il cloro non assume mai valori inferiori a 35,5 ma sempre tale o multiplo intero di questo:
106,5 : 35,5 = 3
213 :35,5 = 6
Possiamo definire quindi 35,5 atomo di cloro, massa atomica relativa del cloro - volgarmente detta peso atomico del cloro. La formula minima dell’acido cloridrico è quindi inequivocabilmente HCl. Con questa maniera abbiamo trovato il peso atomico di un elemento di cui non potevamo misurare direttamente la massa relativa.
Vedete quanto é potente ancora la ipotesi di Avogadro ?
La tecnica ovviamente, a quei tempi fu estesa ad altri composti contenenti altri elementi e si risolse la formula minima di decine di composti. Con ció fugati tutti i dubbi su quella di alcuni elementi quali O2, N2, Cl2, Br2, I2, uscendo per sempre dalla confusione che regnava nella chimica riguardo le formule fino ai tempi di Cannizzaro. Essendo un chimico organico, Cannizzaro si dedicò molto al carbonio di cui trovò il peso atomico col metodo descritto e dedusse le formule di molti composti organici.
Riporto in tabella:
Tuttavia, non tutti gli elementi sono gassosi e non tutti fanno composti gassificabili, così Cannizzaro ricorse a un’altra correlazione già nota ai fisici per trovare i pesi molecolari e le rispettive formule: la legge dei calori specifici ( Dulong e Petit ). Era già stato scoperto che il prodotto fra il peso atomico e il calore specifico di una sostanza fa sempre 6. Non che faccia sempre esattamente 6 ma l’unità, a parte qualche eccezione di 5,9... e 7,0... è sempre 6, cambiano solo i decimali. Nel caso si tratti un composto allora è il peso molecolare per il calore specifico diviso il numero di atomi nella molecola a fare 6. Cannizzaro sfruttò questa relazione per trovare i pesi atomici, molecolari di molti altri composti e le formule minime di molti sali alcalini.
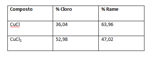
Facciamo l’esempio del rame e dei suoi cloruri, chiamati qui protocloruro e deuterocloruro ( cioé primo e secondo cloruro ). Dalla somiglianza coi cloruri di mercurio, ipotizziamo una formula CuCl per il primo e CuCl2 per il secondo. Facciamo l’analisi elementare otteniamo:
Non essendo gassificabili non possiamo misurarne direttamente il peso molecolare, tuttavia conosciamo il peso atomico del cloro ed essendo composto solamente da rame e cloro con una proporzione possiamo risalire al contributo del rame nel peso molecolare. Calcoliamo:
Otteniamo 63 che confermiamo con la legge dei calori specifici
63 x 0,09515 = 6
Misurando il calore specifico del rame metallico e moltiplicando per 63 otteniamo 6. Questo ci dice che 63 è un valore credibile per il rame e ci conferma pure le formule minime scelte. Se invece ipotizzassimo CuCl3 e CuCl4 per i due cloruri otterremmo:
Che sarebbero già da scartare perchè valori diversi e non multipli interi l’uno dell’altro e inoltre nessuno dei due da 6 moltiplicato per il calore specifico del rame. Potete sbizzarrirvi a provare con altre formule tipo Cu2Cl ecc... per vedere l’affidabilità del metodo. Invece noi qui continuiamo usando sempre la legge dei calori specifici sul protocloruro di rame come ulteriore conferma che 63 è il peso atomico del rame. Il calore specifico nell’unità di peso del protocloruro di rame è 0,13827, quindi, dando 63 al rame, il peso molecolare di CuCl viene 98,5:
Otteniamo un valore che rispetta alla grande la legge. Continua...
I seguenti utenti ringraziano zodd01 per questo messaggio: RhOBErThO, NaClO, Claudio, A.Berenini